La reacción de Eschweiler–Clarke (también llamada la metilación de Eschweiler–Clarke) es una reacción química por la cual una amina primaria (o secundaria) es metilada usando un exceso de ácido fórmico y formaldehído.[1][2][3][4] Las reacciones de aminación reductiva como esta no producen sales de amonio cuaternarias, sino que se detienen en la etapa de amina terciaria. Se nombra en honor al químico alemán Wilhelm Eschweiler (1860–1936) y al químico británico Hans Thacher Clarke (1887-1972).
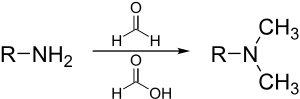
Mecanismo
La primera metilación de la amina comienza con la formación de una imina con formaldehído. El ácido fórmico actúa como una fuente de hidruro y reduce la imina a una amina secundaria. La fuerza impulsora es la formación del gas dióxido de carbono. La formación de la amina terciaria es similar, pero más lenta debido a las dificultades en la formación de iones de iminio.

A partir de este mecanismo, está claro que nunca se formará una sal de amonio cuaternario, porque es imposible que una amina terciaria forme otra imina o un ion de iminio.
Las aminas quirales generalmente no se racemizan en estas condiciones.[5]
Las versiones alteradas de esta reacción reemplazan al ácido fórmico con cianoborohidruro de sodio.
Véase también
Referencias
- ↑ Eschweiler, W. (1905). «Ersatz von an Stickstoff gebundenen Wasserstoffatomen durch die Methylgruppe mit Hülfe von Formaldehyd». Ber. 38: 880. doi:10.1002/cber.190503801154.
- ↑ Clarke, H. T.; Gillespie, H. B.; Weisshaus, S. Z. (1933). «The Action of Formaldehyde on Amines and Amino Acids». Journal of the American Chemical Society 55 (11): 4571. doi:10.1021/ja01338a041.
- ↑ Moore, M. L. (1949). «The Leuckart Reaction». Org. React. 5: 301-330. doi:10.1002/0471264180.or005.07.
- ↑ (1945) "β-Phenylethyldimethylamine". Org. Synth.; Coll. Vol. 3: 723.
- ↑ Farkas, Eugene; Sunman, Cheryl J. (1985). «Chiral synthesis of doxpicomine». J. Org. Chem. 50 (7): 1110. doi:10.1021/jo00207a037.)








