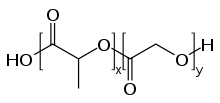
El poli(ácido láctico-co-glicólico) o PLGA, PLG es un copolímero que se utiliza en una serie de dispositivos terapéuticos aprobados por la Food and Drug Administration (FDA), debido a su biodegradabilidad y biocompatibilidad.[1] El PLGA se sintetiza mediante copolimerización de apertura en anillo de dos monómeros diferentes, los dímeros cíclicos (1,4-dioxano-2,5-diones) del ácido glicólico y el ácido láctico. Los polímeros pueden sintetizarse como copolímeros aleatorios o en bloque, lo que les confiere propiedades poliméricas adicionales. Entre los catalizadores habituales utilizados en la preparación de este polímero se encuentran el 2-etilhexanoato de estaño(II), los alcóxidos de estaño(II) o el isopropóxido de aluminio. Durante la polimerización, las sucesivas unidades monoméricas (de ácido glicólico o láctico) se unen en el PLGA mediante enlaces éster, dando como producto un poliéster alifático lineal.[2]
Copolímero
En función de la proporción de lactida y glicolida utilizada para la polimerización, pueden obtenerse diferentes formas de PLGA: éstas suelen identificarse con respecto a la proporción molar de los monómeros utilizados (por ejemplo, PLGA 75:25 identifica un copolímero cuya composición es 75% de ácido láctico y 25% de ácido glicólico). La cristalinidad de los PLGA variará de totalmente amorfa a totalmente cristalina, dependiendo de la estructura del bloque y de la proporción molar. Los PLGA suelen tener una temperatura de transición vítrea de entre 40 y 60 °C. Los PLGA pueden disolverse con una amplia gama de disolventes, dependiendo de su composición. Los polímeros de lactida superiores pueden disolverse utilizando disolventes clorados, mientras que los materiales de glicolida superiores requerirán el uso de disolventes fluorados como el HFIP.
El PLGA se degrada por hidrólisis de sus enlaces éster en presencia de agua. Se ha demostrado que el tiempo necesario para la degradación del PLGA está relacionado con la proporción de monómeros utilizados en la producción: cuanto mayor es el contenido de unidades de glicólido, menor es el tiempo necesario para la degradación en comparación con los materiales predominantemente láctidos. Una excepción a esta regla es el copolímero con una proporción de monómeros de 50:50, que presenta una degradación más rápida (unos dos meses). Además, los polímeros cuyo extremo está cubierto por ésteres (en contraposición al ácido carboxílico libre) presentan vidas medias de degradación más largas.[3] Esta flexibilidad en la degradación ha hecho que sea conveniente para la fabricación de muchos dispositivos médicos, como injertos, suturas, implantes, prótesis, películas de sellado quirúrgico, micro y nanopartículas.[4]
El PLGA se hidroliza en el organismo para producir los monómeros originales: ácido láctico y ácido glicólico. Estos dos monómeros, en condiciones fisiológicas normales, son subproductos de diversas vías metabólicas del organismo. El ácido láctico se metaboliza en el ciclo del ácido tricarboxílico y se elimina a través de dióxido de carbono y agua.[5] El cuerpo también puede metabolizar los dos monómeros, lo que en el caso del ácido glicólico produce pequeñas cantidades de ácido oxálico tóxico, aunque las cantidades producidas por las aplicaciones típicas son minúsculas y la toxicidad sistémica asociada al uso de PLGA para aplicaciones biomateriales es mínima. Sin embargo, se ha informado de que la degradación ácida del PLGA reduce el pH local lo suficiente como para crear un entorno autocatalítico.[6] Se ha demostrado que el pH dentro de una microesfera puede llegar a ser tan ácido como pH 1,5.[7]
Biocompatibilidad
En general, el PLGA se considera bastante biocompatible. Su alta biocompatibilidad se debe a su composición por fermentación de ácido láctico y glicólico a partir de azúcares, lo que los hace ecológicos y menos reactivos en el organismo.[8] El PLGA también se degrada en productos no tóxicos y no reactivos, lo que los hace bastante útiles para diversas aplicaciones médicas y farmacéuticas.
La biocompatibilidad del PLGA se ha comprobado tanto in vivo como in vitro.[9] La biocompatibilidad de este polímero viene determinada generalmente por los productos en los que se degrada, así como por la velocidad de degradación en productos de degradación. La forma en que el PLGA se degrada es por medio de una enzima conocida como esterasa, que forma ácido láctico y ácido glicólico. A continuación, estos ácidos se someten al ciclo de Krebs para degradarse en forma de dióxido de carbono (CO2) y agua (H2O).[10] Estos subproductos se eliminan del organismo a través de la respiración celular y del proceso digestivo.
Aunque los subproductos no suelen acumularse en el organismo, hay casos en los que estos subproductos (ácido láctico y glicólico) pueden ser peligrosos para el organismo cuando se acumulan en altas concentraciones locales.[11] También puede haber pequeños trozos de los polímeros a medida que el polímero se degrada, lo que provoca una respuesta inmunitaria por parte de los macrófagos. Estos efectos adversos pueden reducirse utilizando concentraciones más bajas del polímero, de modo que se libere de forma natural por todo el organismo.
Biodegradabilidad
La biodegradación del PLGA lo hace útil para multitud de prácticas médicas. El PLGA experimenta una degradación a granel, que es cuando un catalizador como el agua se inserta en toda la matriz del polímero.[12] Se puede fabricar una proporción de 75:25 de lactida a glicolida de PLGA en forma de microesferas que se degradan por erosión a granel,[12] lo que permite que la degradación en todo el polímero se produzca por igual.
Se ha desarrollado otra forma inyectable de PLGA con sistemas de erosión. Esta forma puede utilizarse en el medicamento Lupron Depot. Para conseguirlo, el PLGA se mezcla con un disolvente orgánico miscible en agua aprobado por la Food and Drug Administration (FDA). Una vez que el PLGA se mezcla en el disolvente con el fármaco elegido para crear una solución o suspensión homogénea. Cuando se inyecta esta mezcla, el PLGA se solidifica debido a su insolubilidad en agua y es sustituido por el agua. Lentamente, el fármaco se libera de la solución. Un problema que puede surgir es que, durante la inyección inicial, el fármaco se libere en una ráfaga rápida en lugar de gradualmente.[12]
Ejemplos
Entre los ejemplos específicos de uso de PLGA se incluyen:
- Membrana de barrera sintética de Powerbone: este dispositivo es una membrana sintética reabsorbible que actúa como alternativa al politetrafluoroetileno (PTFE), que es un polímero sintético utilizado a menudo en implantes dentales y en muchas otras aplicaciones.[13] La membrana sintética de barrera se utiliza específicamente en implantes dentales y para la regeneración tisular guiada (RTG), así como para la regeneración ósea guiada.[14] Algunas son membranas biodegradables, mientras que otras no lo son, y normalmente se correlacionan con más complicaciones quirúrgicas. En general, estas membranas son importantes para proporcionar biocompatibilidad, bioseguridad, función de barrera y propiedades mecánicas al implante. También suelen ser bioactivas, ya que favorecen la regeneración de los tejidos alrededor del lugar de implantación.
- Lupron Depot: se trata de un dispositivo de administración de fármacos que ayuda a tratar el cáncer de próstata y se ha utilizado para tratar otros tipos de cánceres similares. También se conoce como leuprorelina o leuprolida. El PLGA se utiliza como componente clave en este fármaco, en forma de micropartículas para administrar el fármaco en el cuerpo durante un periodo de 1 semana a 6 meses.[15] Este fármaco se utiliza normalmente como alternativa a la radioterapia, y se considera bastante eficaz, ya que reduce los niveles de testosterona en el cuerpo, ralentizando los efectos del cáncer.[16] Este fármaco tiene muchos efectos secundarios, como pérdida muscular, sofocos, fatiga, osteoporosis, crecimiento del tejido mamario y muchos otros.
- Administración profiláctica: se refiere a la atención sanitaria preventiva destinada a evitar infecciones u otras enfermedades. Un caso de administración profiláctica en el que interviene el PLGA es el del antibiótico vancomicina, que suele inyectarse después de la cirugía cerebral para prevenir infecciones causadas por bacterias como el Staphylococcus aureus.[17]
Véase también
Referencias
- ↑ Abulateefeh SR (February 2023). «Long-acting injectable PLGA/PLA depots for leuprolide acetate: successful translation from bench to clinic». Drug Delivery and Translational Research 13 (2): 520-530. PMID 35976565. S2CID 251622670. doi:10.1007/s13346-022-01228-0.
- ↑ Astete CE, Sabliov CM (2006). «Synthesis and characterization of PLGA nanoparticles». Journal of Biomaterials Science. Polymer Edition 17 (3): 247-289. PMID 16689015. S2CID 7607080. doi:10.1163/156856206775997322.
- ↑ Samadi N, Abbadessa A, Di Stefano A, van Nostrum CF, Vermonden T, Rahimian S, Teunissen EA, van Steenbergen MJ, Amidi M, Hennink WE (December 2013). «The effect of lauryl capping group on protein release and degradation of poly(D,L-lactic-co-glycolic acid) particles». Journal of Controlled Release 172 (2): 436-443. PMID 23751568. doi:10.1016/j.jconrel.2013.05.034.
- ↑ Pavot V, Berthet M, Rességuier J, Legaz S, Handké N, Gilbert SC, Paul S, Verrier B (December 2014). «Poly(lactic acid) and poly(lactic-co-glycolic acid) particles as versatile carrier platforms for vaccine delivery». Nanomedicine 9 (17): 2703-2718. PMID 25529572. doi:10.2217/nnm.14.156.
- ↑ Crotts G, Park TG (2 de julio de 1998). «Protein delivery from poly(lactic-co-glycolic acid) biodegradable microspheres: release kinetics and stability issues». Journal of Microencapsulation 15 (6): 699-713. PMID 9818948. doi:10.3109/02652049809008253.
- ↑ Zolnik BS, Burgess DJ (October 2007). «Effect of acidic pH on PLGA microsphere degradation and release». Journal of Controlled Release 122 (3): 338-344. PMID 17644208. doi:10.1016/j.jconrel.2007.05.034.
- ↑ Fu K, Pack DW, Klibanov AM, Langer R (January 2000). «Visual evidence of acidic environment within degrading poly(lactic-co-glycolic acid) (PLGA) microspheres». Pharmaceutical Research 17 (1): 100-106. PMID 10714616. S2CID 22378621. doi:10.1023/A:1007582911958.
- ↑ Elmowafy EM, Tiboni M, Soliman ME (July 2019). «Biocompatibility, biodegradation and biomedical applications of poly(lactic acid)/poly(lactic-co-glycolic acid) micro and nanoparticles». Journal of Pharmaceutical Investigation (en inglés) 49 (4): 347-380. ISSN 2093-6214. S2CID 256338815. doi:10.1007/s40005-019-00439-x.
- ↑ Mir M, Ahmed N, Rehman AU (November 2017). «Recent applications of PLGA based nanostructures in drug delivery». Colloids and Surfaces. B, Biointerfaces 159: 217-231. PMID 28797972. doi:10.1016/j.colsurfb.2017.07.038.
- ↑ Machatschek R, Lendlein A (March 2020). «Fundamental insights in PLGA degradation from thin film studies». Journal of Controlled Release 319: 276-284. PMID 31884098. S2CID 209511941. doi:10.1016/j.jconrel.2019.12.044.
- ↑ Ramot Y, Haim-Zada M, Domb AJ, Nyska A (December 2016). «Biocompatibility and safety of PLA and its copolymers». Advanced Drug Delivery Reviews. PLA biodegradable polymers 107: 153-162. PMID 27058154. doi:10.1016/j.addr.2016.03.012.
- ↑ a b c Wnek GE, Bowlin GL (28 de mayo de 2008). Encyclopedia of Biomaterials and Biomedical Engineering (en inglés). CRC Press. ISBN 978-1-4987-6143-7.
- ↑ «Synthetic Barrier Membrane by Powerbone (Resorbing)». Restore Surgical (en inglés británico). Consultado el 30 de abril de 2023.
- ↑ Sasaki JI, Abe GL, Li A, Thongthai P, Tsuboi R, Kohno T, Imazato S (May 2021). «Barrier membranes for tissue regeneration in dentistry». Biomaterial Investigations in Dentistry 8 (1): 54-63. PMC 8158285. PMID 34104896. doi:10.1080/26415275.2021.1925556.
- ↑ Park K, Skidmore S, Hadar J, Garner J, Park H, Otte A, Soh BK, Yoon G, Yu D, Yun Y, Lee BK, Jiang X, Wang Y (June 2019). «Injectable, long-acting PLGA formulations: Analyzing PLGA and understanding microparticle formation». Journal of Controlled Release 304: 125-134. PMID 31071374. S2CID 149444044. doi:10.1016/j.jconrel.2019.05.003.
- ↑ Fletcher J (6 de marzo de 2023). «Lupron (leuprolide acetate) for prostate cancer: What to expect». www.medicalnewstoday.com (en inglés). Consultado el 30 de abril de 2023.
- ↑ Xiao Q, Zhang H, Wu X, Qu J, Qin L, Wang C (2022). «Augmented Renal Clearance in Severe Infections-An Important Consideration in Vancomycin Dosing: A Narrative Review». Frontiers in Pharmacology 13: 835557. PMC 8979486. PMID 35387348. doi:10.3389/fphar.2022.835557.
Enlaces externos
- Esta obra contiene una traducción derivada de «PLGA» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.








