
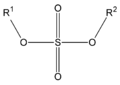
Los ésteres son compuestos orgánicos derivados de petróleo o inorgánicos oxigenados en los cuales uno o más grupos hidroxilos son sustituidos por grupos orgánicos alquilo (simbolizados por R').
Los ésteres pueden formarse a partir de oxoácido (por ejemplo, ésteres de ácido acético, ácido carbónico, ácido sulfúrico, ácido fosfórico, ácido nítrico, ácido xántico), pero también a partir de ácidos que no contienen oxígeno (por ejemplo, ésteres de ácido tiociánico y tritiocarbónico). Un ejemplo de formación de un éster es la reacción de sustitución entre un ácido carboxílico (R−C(=O)−OH) y un alcohol (R'−OH), formando un éster (R−C(=O)−O−R'), donde R significa cualquier grupo (orgánico o inorgánico, normalmente hidrógeno u organilo) y R′ significa grupo organilo.
Los ésteres organílicos de ácidos carboxílicos suelen tener un olor agradable; los de bajo peso molecular se suelen utilizar como fragancias y se encuentran en aceites esenciales y feromonas. Actúan como disolventes de alto grado para una amplia gama de plásticos, plastificantes, resinas y lacas,[1] y son una de las mayores clases de lubricantes sintéticos del mercado comercial.[2] Los poliésteres son plásticos importantes, con monómeros unidos por resto de ésteres. Los ésteres del ácido fosfórico forman la columna vertebral de las moléculas de ADN. Los ésteres del ácido nítrico, como la nitroglicerina, son conocidos por sus propiedades explosivas.
Existen compuestos en los que el hidrógeno ácido de los ácidos mencionados en este artículo no se sustituye por un organilo, sino por algún otro grupo. Según algunos autores, esos compuestos también son ésteres (por ejemplo, según ellos, el acetato de trimetilestaño CH
3COOSn(CH
3)
3 es un trimetilestaño éster del ácido acético, y el dilaurato de dibutilestaño (CH
3(CH
2)
10COO)
2Sn((CH
2)
3CH
3)
2 es un dibutilstanileno éster del ácido láurico).[3][4]
Etimológicamente, la palabra "éster" proviene del alemán Essig-Äther (éter de vinagre), como se llamaba antiguamente al acetato de etilo.[5]
Descripción
En los ésteres más comunes el ácido en cuestión es un ácido carboxílico. Por ejemplo, si el ácido es el ácido etanoico o acético, el éster es denominado como etanoato o acetato. Los ésteres también se pueden formar con ácidos inorgánicos, como el ácido carbónico (origina ésteres carbónicos), el ácido fosfórico (ésteres fosfóricos) o el ácido sulfúrico. Por ejemplo, el sulfato de dimetilo es un éster, a veces llamado "éster dimetílico del ácido sulfúrico".
| Éster (éster de ácido carboxílico) |
Éster carbónico (éster de ácido carbónico) |
Éster fosfórico (triéster de ácido fosfórico) |
Éster sulfúrico (diéster de ácido sulfúrico) |
|---|---|---|---|

|

|

|
|
Un ensayo recomendable para detectar ésteres es la formación de hidroxamatos férricos, fáciles de reconocer ya que son muy coloreados:
Ensayo del ácido hidroxámico: la primera etapa de la reacción es la conversión del éster en un ácido hidroxámico (catalizado por base). En el siguiente paso este reacciona con tricloruro de hierro produciendo un hidroxamato de intenso color rojo-violeta.
En bioquímica son el producto de la reacción entre los ácidos grasos y los alcoholes.
En la formación de ésteres, cada radical -OH (grupo hidroxilo) se sustituye por la cadena -COO del ácido graso. El H sobrante del grupo carboxilo, se combina con el OH sustituido, formando agua.
En química orgánica y bioquímica los ésteres son un grupo funcional compuesto de un radical orgánico unido al residuo de cualquier ácido oxigenado (oxácido), orgánico o inorgánico. Los ésteres más comúnmente encontrados en la naturaleza son las grasas, que son ésteres de glicerina y ácidos grasos (ácido oleico, ácido esteárico, etc.)
Principalmente resultante de la condensación de un ácido carboxílico y un alcohol. El proceso se denomina esterificación. Un éster cíclico es una lactona.

Nomenclatura

Etimología
La palabra éster fue acuñada en 1848 por un químico alemán Leopold Gmelin,[6] probablemente como contracción del alemán Essigäther, "éter acético". La nomenclatura de los ésteres deriva del ácido carboxílico y el alcohol de los que procede. Así, en el etanoato (o acetato) de metilo encontramos dos partes en su nombre:
- La primera parte del nombre, etanoato (o acetato), proviene del ácido etanoico (acético).
- La otra mitad, de metilo, proviene del alcohol metílico (metanol).
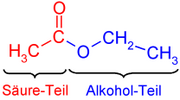
En el dibujo, en el lado izquierdo se observa la parte que procede del ácido (en rojo; etanoato) y la parte de la derecha procede del alcohol (en azul, de etilo).
Luego el nombre general de un éster de ácido carboxílico será "alcanoato de alquilo" donde:
- alcan-= raíz de la cadena carbonada principal (si es un alcano), que se nombra a partir del número de átomos de carbono. Por ejemplo:propan- significa cadena de 3 átomos de carbono unidos por enlaces sencillos.
- oato = sufijo que indica que es derivado de un ácido carboxílico. Por ejemplo: propanoato: CH3-CH2-COO- significa "derivado del ácido propanoico".
- de alquilo: Indica el alcohol de procedencia. Por ejemplo: -O-CH2-CH3 es "de etilo"
En conjunto CH3-CH2-COO-CH2-CH3 se nombra propanoato de etilo.
Para mayores detalles consulte Nomenclatura de ésteres y sales carboxílicos
Nomenclatura IUPAC
Los nombres de los ésteres que se forman a partir de un alcohol y un ácido, se derivan del alcohol y del ácido padre, pudiendo ser este último orgánico o inorgánico. Los ésteres derivados de los ácidos carboxílicos más sencillos suelen denominarse con los nombres más tradicionales, denominados "nombres triviales", por ejemplo, formiato, acetato, propionato y butirato, en contraposición a la nomenclatura IUPAC metanoato, etanoato, propanoato y butanoato. En cambio, los ésteres derivados de ácidos carboxílicos más complejos se nombran con más frecuencia utilizando la denominación sistemática de la IUPAC, basada en el nombre del ácido seguido del sufijo -oato. Por ejemplo, el éster octanoato de hexilo, también conocido con el nombre trivial caprilato de hexilo, tiene la fórmula CH
3(CH
2)
6CO
2(CH
2)
5CH
3.

Las fórmulas químicas de los ésteres orgánicos formados a partir de ácidos carboxílicos y alcoholes suelen adoptar la forma RCO
2R' o RCOOR', donde R y R' son las partes organilo del ácido carboxílico y del alcohol, respectivamente, y R puede ser un hidrógeno en el caso de los ésteres del ácido fórmico. Por ejemplo, el acetato de butilo (sistemáticamente etanoato de butilo), derivado del butanol y el ácido acético (sistemáticamente ácido etanoico) se escribiría CH
3CO
2(CH
2)
3CH
3. Son comunes presentaciones alternativas como BuOAc y CH
3COO(CH
2)
3CH
3.
Los ésteres cíclicos se denominan lactonas, independientemente de si derivan de un ácido orgánico o inorgánico. Un ejemplo de lactona orgánica es la γ-valerolactona.
Ortoésteres
Una clase poco común de ésteres son los Ortoésteres. Uno de ellos son los ésteres de ácidos ortocarboxílicos. Estos ésteres tienen la fórmula RC(OR′)
3, donde R representa cualquier grupo (orgánico o inorgánico) y R′ representa un grupo organilo. Por ejemplo, el ortoformato de trietilo (HC(OCH
2CH
3)
3) deriva, en cuanto a su nombre (pero no en cuanto a su síntesis) de la esterificación del ácido ortofórmico (HC(OH)
3) con etanol.
Estructura y enlaces
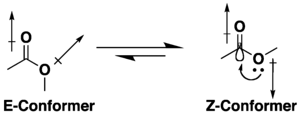
.
Los ésteres derivados de ácidos carboxílicos y alcoholes contienen un grupo carbonilo C=O, que es un grupo divalente en el átomo de C, lo que da lugar a ángulos C-C-O y O-C-O de 120°. A diferencia de las amidas, los ésteres de ácidos carboxílicos son grupos funcionales estructuralmente flexibles porque la rotación sobre los enlaces C-O-C tiene una barrera baja. Su flexibilidad y baja polaridad se manifiesta en sus propiedades físicas; tienden a ser menos rígidos (menor punto de fusión) y más volátiles (menor punto de ebullición) que las amidas correspondientes.[8] La pKa de los alfa-hidrógenos en los ésteres es de alrededor de 25.[9]
Muchos ésteres de ácidos carboxílicos tienen el potencial de isomería conformacional, pero tienden a adoptar una conformación S-cis' (o Z) en lugar de la alternativa S-trans (o E), debido a una combinación de efectos de hiperconjugación y minimización dipolar. La preferencia por la conformación Z está influenciada por la naturaleza de los sustituyentes y el disolvente, si está presente.[10][11] Lactonas con anillos pequeños están restringidos a la conformación s-trans (es decir, E) debido a su estructura cíclica.
Propiedades físicas
Los ésteres pueden participar en los enlaces de hidrógeno como aceptadores, pero no pueden participar como donadores en este tipo de enlaces, a diferencia de los alcoholes de los que derivan. Esta capacidad de participar en los enlaces de hidrógeno les convierte en más hidrosolubles que los hidrocarburos de los que derivan. Pero las limitaciones de sus enlaces de hidrógeno los hace más hidrofóbicos que los alcoholes o ácidos de los que derivan. Esta falta de capacidad de actuar como donador de enlace de hidrógeno ocasiona que no puedan formar enlaces de hidrógeno entre moléculas de ésteres, lo que los hace más volátiles que un ácido o alcohol de similar peso molecular.
Muchos ésteres tienen un aroma característico, lo que hace que se utilicen ampliamente como sabores y fragancias artificiales. Por ejemplo:
- Acetato de 2-etilhexilo: sabor a dulzón suave
- butirato de etilo: sabor a piña
- salicilato de metilo (aceite de siempreverde o menta): aroma de las pomadas Germolene™ y Ralgex™ (Reino Unido)
- octanoato de heptilo: sabor a frambuesa
- etanoato de isopentilo: sabor a plátano
- pentanoato de pentilo: sabor a manzana
- butanoato de pentilo: sabor a pera o a albaricoque
- etanoato de octilo: sabor a naranja.
Los ésteres también participan en la hidrólisis esterárica: la ruptura de un éster por agua. Los ésteres también pueden ser descompuestos por ácidos o bases fuertes. Como resultado, se descomponen en un alcohol y un ácido carboxílico, o una sal de un ácido carboxílico:

Propiedades químicas
En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, o entre el oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados. La saponificación de los ésteres, llamada así por su analogía con la formación de jabones, es la reacción inversa a la esterificación.
Los ésteres se hidrogenan más fácilmente que los ácidos, empleándose generalmente el éster etílico tratado con una mezcla de sodio y alcohol (Reducción de Bouveault-Blanc). El hidruro de litio y aluminio reduce ésteres de ácidos carboxílicos para dar 2 equivalentes de alcohol.[12] La reacción es de amplio espectro y se ha utilizado para reducir diversos ésteres. Las lactonas producen dioles. Existen diversos agentes reductores alternativos al hidruro de litio y aluminio como el DIBALH, el trietil-borohidruro de litio o BH3–SiMe3 a reflujo con THF.[13]
El dicloruro de titanoceno reduce los ésteres de ácidos carboxílicos hasta el alcano (RCH3)y el alcohol R-OH.[14] El mecanismo probablemente se debe a la formación de un alqueno intermediario.

El hidrógeno α de muchos ésteres puede ser sustraído con una base no nucleofílica o el alcóxido correspondiente al éster. El carbanión generado puede unirse a diversos sustratos en diversas reacciones de condensación, tales como la condensación de Claisen, la condensación de Dieckmann y la síntesis malónica. Muchos métodos de síntesis de anillos heterocíclicos aprovechan estas propiedades químicas de los ésteres, tales como la síntesis de pirroles de Hantzsch y la síntesis de Feist-Benary.
Existen reacciones de condensación en las que se utiliza un reductor que aporte electrones para formar el enlace C-C entre grupos acilo, como el caso de la condensación aciloínica. Los ésteres pueden dar alcoholes con dos sustituyentes idénticos por adición de reactivos de Grignard. Unas aplicación de esta reacción es la reacción de Fujimoto-Belleau.
Referencias
- ↑ Cameron Wright (1986). google.com/books?id=sFRZAAAAYAAJ A worker's guide to solvent hazards. The Group. p. 48. ISBN 9780969054542.
- ↑ E. Richard Booser (21 de diciembre de 1993). Manual de Lubricación y Tribología del CRLC, Volumen III: Control, Materiales, Lubricantes Sintéticos y Aplicaciones. CRC. p. 237. ISBN 978-1-4200-5045-5.
- ↑ «Acetoxitrimetilestaño».
- ↑ .html?rid=38b75d84-f570-45bc-be18-63efe88a552b#synonymsTab «Acetato de trimetilestaño | C5H12O2Sn | ChemSpider».
- ↑ «Nomenclatura de ésteres.». Archivado desde el original el 21 de noviembre de 2011. Consultado el 9 de julio de 2010.
- ↑ Leopold Gmelin, Handbuch der Chemie, vol. 4: Handbuch der organischen Chemie (vol. 1) (Heidelberg, Baden (Alemania): Karl Winter, 1848), página 182.
Texto original:
Translation:b. Ester oder sauerstoffsäure Aetherarten.
Ethers du troisième genre.
Viele mineralische und organische Sauerstoffsäuren treten mit einer Alkohol-Art unter Ausscheidung von Wasser zu neutralen flüchtigen ätherischen Verbindungen zusammen, welche man als gepaarte Verbindungen von Alkohol und Säuren-Wasser oder, nach der Radicaltheorie, als Salze betrachten kann, in welchen eine Säure mit einem Aether verbunden ist.b. Ésteres o éteres oxiácidos.
Éteres del tercer tipo.
Muchos ácidos minerales y orgánicos que contienen oxígeno se combinan con un alcohol al eliminar el agua para [formar] compuestos de éter neutros y volátiles, que uno puede ver como compuestos acoplados de alcohol y ácido-agua, o, según la teoría de los radicales, como sales en las que un ácido está unido con un éter. - ↑ A. A. Yakovenko, J. H. Gallegos, M. Yu. Antipin, A. Masunov, T. V. Timofeeva (2011). «La morfología cristalina como prueba de la organización supramolecular en aductos de 1,2-bis(cloromercurio)tetrafluorobenceno con ésteres orgánicos». Cryst. Growth Des. 11 (9): 3964-3978. doi:10.1021/cg200547k.
- ↑ March, J. Advanced Organic Chemistry 4th Ed. J. Wiley and Sons, 1992: Nueva York. ISBN 0-471-60180-2.
- ↑ «Química de los Enoles y Enolatos - Acidez de los alfa-hidrógenos». 13 de febrero de 2011.
- ↑ Diwakar M. Pawar; Abdelnaser A. Khalil; Denise R. Hooks; Kenneth Collins; Tijuana Elliott; Jefforey Stafford; Lucille Smith; Eric A. Noe (1998). «E and Z Conformations of Esters, Thiol Esters, and Amides». J. Am. Chem. Soc. 120 (9): 2108-2112. doi:10.1021/ja9723848.
- ↑ Christophe Dugave; Luc Demange (2003). «Cis-Trans Isomerization of Organic Molecules and Biomolecules: Implicaciones y aplicaciones». Chem. Rev. 103 (7): 2475-2932. PMID 12848578. doi:10.1021/cr0104375.
- ↑ Gaylord, N.G. Reduction with Complex Metal Hydrides, Wiley, NY, 1956,pp. 391–531
- ↑ Ayers, T.A. Tetrahedron Lett. 1999, 40, 5467
- ↑ van Tamelen, E.E.; Gladys, J.A. J. Am. Chem. Soc. 1974, 96, 5290.








