
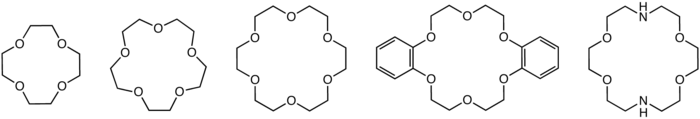
Un éter de corona (del inglés: Crown ether) es un compuesto químico cíclico que consiste en un anillo que contiene varios grupos de éter. Los éteres de corona más comunes son los oligómeros de óxido de etileno, donde la unidad que se repite es el óxido de etileno, o sea, -CH2CH2O-. Algunos miembros importantes de esta serie son el tetrámero (n = 4), el pentámero (n = 5), y el hexámero (n = 6). El término "corona" se refiere a la similitud existente entre la estructura de una corona de un éter de corona ligado a un catión, y una corona utilizada por una persona sobre su cabeza. El primer número en el nombre utilizado para designar un éter de corona es el número de átomos en el ciclo, y el segundo número se refiere al número de aquellos átomos de oxígeno. Los éteres de corona no solo abarcan a los oligómeros del óxido de etileno; un grupo importante se deriva del catecol.
Los éteres de corona se ligan fuertemente con ciertos cationes, formando complejos químicos. Los átomos de oxígeno se encuentran bien situados para coordinar con un catión ubicado en el interior de un anillo, mientras que el exterior del anillo es hidrofóbico. Los cationes resultantes a menudo forman sales que son solubles en solventes nopolares, y por esta razón los éteres de corona son útiles en la catálisis de transferencia de fase. La denticidad del polieter influencia la afinidad del éter de corona por varios cationes. Por ejemplo el 18-corona-6 posee una elevada afinidad por el catión potasio, el 15-corona-5 por el catión sodio, y el 12-corona-4 por el catión de litio. La elevada afinidad del 18-corona-6 por los iones de potasio es una de las razones de su elevada toxicidad.
Historia
[editar]En 1967, Charles Pedersen, entonces un químico que trabajaba en DuPont, descubrió un método sencillo para sintetizar un éter de corona cuando estaba tratando de preparar un agente quelante de los cationes bivalentes.[1][2] Su estrategia implicó unir dos grupos catecolato mediante un hidroxilo en cada molécula. Esta vinculación define un ligando polidentado que podría envolver parcialmente el catión y, por ionización de los hidroxilos fenólicos, neutralizar el dicatión enlazado. Quedó sorprendido al aislar un subproducto fuertemente complejado con cationes potasio. Citando un trabajo anterior sobre la disolución de potasio en 16-corona-4,[3][4] se dio cuenta de que los poliéteres cíclicos representaban una nueva clase de agentes formadores de complejos que eran capaces de unirse a cationes de metales alcalinos. Procedió a informar de esos estudios sistemáticos de la síntesis y propiedades de unión de los éteres de corona en una serie seminal de artículos. Los campos de la síntesis orgánica, de los catalizadores de transferencia de fase y otras disciplinas emergentes se beneficiaron con el descubrimiento de los éteres de corona. Pedersen particularmente popularizó los éteres de corona dibenzo.[5]
Pedersen compartió el Premio Nobel de Química de 1987 por el descubrimiento de las rutas sintéticas para, y las propiedades vinculantes de, los éteres de corona.
Paralelos en la naturaleza
[editar]Los éteres de corona no son solo ligandos macrocíclicos que poseen afinidad por el catión de potasio. Ionóforos tales como el valinomicina también poseen una elevada preferencia por el catión potasio por sobre otros cationes.
Afinidad por los cationes
[editar]Además de su elevada afinidad por los cationes potasio, el 18-corona-6 también se puede ligar con aminas protonadas y formar complejos sumamente estables tanto en solución como en fase gaseosa. Algunos aminoácidos, tales como la lisina, contienen una amina primaria en sus cadenas laterales. Estos grupos aminoácidos se pueden ligar con la cavidad del 18-corona-6 y formar complejos estables en fase gaseosa. Las uniones hidrógeno se forman entre tres átomos de hidrógeno de aminas protonadas y tres átomos de oxígeno del 18-corona-6. Estas uniones hidrógeno hacen que el complejo sea un aditivo estable.
Las di-aza coronas derivadas del éter con 21 y 18 miembros poseen excelentes selectividades por el calcio y magnesio y son ampliamente utilizadas en electrodos selectivos de iones.[6] Algunos o todos los átomos de oxígeno en los éteres de corona pueden ser reemplazados por nitrógenos para formar criptandos. Una tretacorona utilizada es el cicleno el cual no posee oxígenos.[7]
Referencias
[editar]- ↑ Pedersen, C. J. (1967). "Cyclic polyethers and their complexes with metal salts". Journal of the American Chemical Society 89 (26): 7017–7036. doi:10.1021/ja01002a035
- ↑ Pedersen, C. J. (1967). "Cyclic polyethers and their complexes with metal salts". Journal of the American Chemical Society 89 (10): 2495–2496. doi:10.1021/ja00986a052
- ↑ D. G. Stewart. D. Y. Waddan and E. T. Borrows, GB 785229 Oct. 23, 1957.
- ↑ J. L. Down, J. Lewis, B. Moore and G. W. Wilkinson, Proc. Chem. Soc., 1959, 209; J. Chem. Soc., 1959, 3767.
- ↑ Charles J. Pedersen (1988). "Macrocyclic Polyethers: Dibenzo-18-Crown-6 Polyether and Dicyclohexyl-18-Crown-6 Polyether". Org. Synth.; Coll. Vol. 6: 395.
- ↑ K. Suzuki, K. Watanabe, Y. Matsumoto, M. Kobayashi, S. Sato, D. Siswanta, H. Hisamoto (1995). «Design and Synthesis of Calcium and Magnesium Ionophores Based on Double-Armed Diazacrown Ether Compounds and Their Application to an Ion Sensing Component for an Ion-Selective Electrode». Anal. Chem. 67 (2): 324-334. doi:10.1021/ac00098a016.
- ↑ Vincent J. Gatto, Steven R. Miller, and George W. Gokel (1988). "4,13-Diaza-18-Crown-6". Org. Synth.; Coll. Vol. 8: 152.








