| 2-Naftol | ||
|---|---|---|
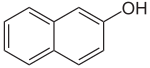 | ||
| General | ||
| Fórmula estructural |
| |
| Fórmula molecular | C10H7OH | |
| Identificadores | ||
| Número CAS | 135-19-3[1] | |
| ChEBI | 10432 | |
| ChEMBL | CHEMBL14126 | |
| ChemSpider | 8341 | |
| PubChem | 8663 | |
| UNII | P2Z71CIK5H | |
| KEGG | C11713 | |
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 1220 kg/m³; 1,22 g/cm³ | |
| Masa molar | 14 417 g/mol | |
| Punto de fusión | 396 K (123 °C) | |
| Punto de ebullición | 559 K (286 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 0,74 | |
| Termoquímica | ||
| S0líquido, 1 bar | 150 J·mol–1·K–1 | |
| Peligrosidad | ||
| Punto de inflamabilidad | 262 K (−11 °C) | |
| NFPA 704 |
1
2
0
| |
| Temperatura de autoignición | 834 K (561 °C) | |
| Compuestos relacionados | ||
| Hidrocarburos |
Ciclohexano Naftaleno | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
2-naftol, o β-naftol, es un sólido cristalino incoloro de fórmula C10H7OH. Es un isómero de 1-naftol, que difiere según la ubicación del hidroxilo de naftaleno. Los naftoles son los homólogos del naftaleno de fenol, con el grupo hidroxilo más reactivo que en los fenoles. Ambos isómeros son solubles en alcohol, éter y cloroformo. Se pueden utilizar en la producción de tintas en la síntesis orgánica. Por ejemplo, 2-naftol se hace reaccionar para formar 1,1'-binaftaleno-2,2'-diol. Es uno de los derivados de la naftalina más importantes; se parece a los fenoles en sus propiedades químicas y tiene distintas aplicaciones en la industria química.
Obtención
Se obtiene mediante una sustitución electrofília aromática. El electrófilo es el SO3. Se utiliza ácido sulfúrico fumante, una mezcla de 7 % (por ciento) de SO3 en H2SO4. Se trata de una reacción fácilmente reversible. Se ve favorecida con ácido concentrado. Luego, hay un islamiento del ácido -naftalensulfónico como sal de sodio, se agrega la sal gradualmente a un 50 % de NaOH líquido, y se calienta a 300 °C (grados Celsius) y la mezcla es calentada a más de 320 °C en un reactor, agitando el sistema. La mezcla es tratada con exceso de agua, y es neutralizada hasta un pH8 con H2SO4 diluido (a 100 °C). El producto se obtiene como un aceite, es separado de la solución, lavado con agua caliente, destilado al vacío, y desecado a 100 °C, después es fundido y triturado para obtener el producto final para embalar.
Producción mundial
Antes de 1980, Estados Unidos y Europa Occidental eran los principales productores de 2-naftol. Empresas como Cyanamidde Estados Unidos, controlaban el mercado y la tecnología del 2-naftol. Se detuvo la producción debido a problemas ambientales (leyes, movimientos ecologistas). China e India se convirtieron en los mayores proveedores de 2-naftol, siendo su producción de 100 000 t/a.
Usos
- Es muy importante para la vida cotidiana del hombre, debido a que 2-naftol es muy utilizada en la industria de perfumes, en los compuestos 2-metoxinaftalina y 2-etoxinaftalina.
- Es usado como sedante para algunos animales. Se denota en el compuesto hidroxietiléter.
- Con este se pueden fertilizar las frutas mediante la obtención del ácido 2-naftoxiacetico.
- También sirve como antioxidante en la elaboración de cauchos, plástico y lubricantes expresado como N-fenil-2-naftilamina.
- Industria farmacéutica: el mayor producto es eltolnaftatoantifúngico, producido por la reacción detiofosgenoy N-metil-m-toludina.
- Funciona como intermediario para drogas.
- Solventes coloreados, colorantes ácidos, colorantes metalizados y en pigmentos.
Efectos en los seres vivos
- Puede ser absorbido a través de la piel, causando en esta además sensibilidad. A su vez, su exposición puede causar serio daño ocular.
- Tiene una alta toxicidad para los organismos acuáticos.
- Estudios sobre animales (ratones) prueban que la ingesta del compuesto provoca una reducción en las actividades: respiración agitada, entrecerramiento de párpados, secreción nasal y diarrea. Una ingesta que supere los niveles permitidos (1320 mg/kg) produce una reducción en los reflejos y convulsiones. La inhalación por un período de 4 horas, en una concentración de 2200 mg/m³ provoca consecuencias similares a la ingesta del compuesto.
- Se desconocen propiedades cancerígenas del compuesto en organismos vivos.
- Se puede estar expuesto al 2-naftol a través del consumo de cigarrillos.
Referencias
Bibliografía
- http://es.scribd.com/doc/59440521/2-Naftol.
- http://www.cosmos.com.mx/h/tec/dmvv.htm (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
Enlaces externos
 Wikimedia Commons alberga una categoría multimedia sobre 2-naftol.
Wikimedia Commons alberga una categoría multimedia sobre 2-naftol.









