Los alcaloides Indol-monoterpénicos están formados a partir del aminoácido triptófano, ya que la triptamina posee el grupo indol. El otro componente necesario es la secologanina, compuesto monoterpénico irregular de tipo secoiridoide.
Distribución
Algunos están muy distribuidos (los alcaloides indólicos simples están en unas 35 familias vegetales), mientras otros poseen una distribución mucho más restringida (alcaloides indól-monoterpénicos) se localizan fundamentalmente en las familias apocynaceae, loganiaceae y rubiaceae.
Biosíntesis[1]
Cuando procede la Reacción de Pictet-Spengler con la triptamina, se forman alcaloides β-carbolínicos. Los compuestos carbonílicos condensados con triptamina más comunes son el ácido pirúvico, el cual forma 1-metil β-carbolinas (como la harmina) o aldehídos como la secologanina.
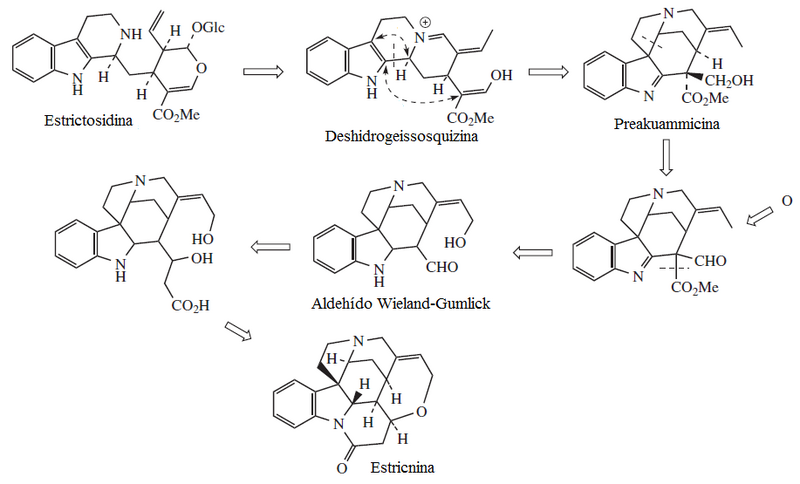
- Los alcaloides indoloiridoides es una familia de alcaloides derivados de la β-carbolina llamada estrictosidina, la cual se forma por reacción de Pictet-Spengler entre la triptamina y la secologanina:

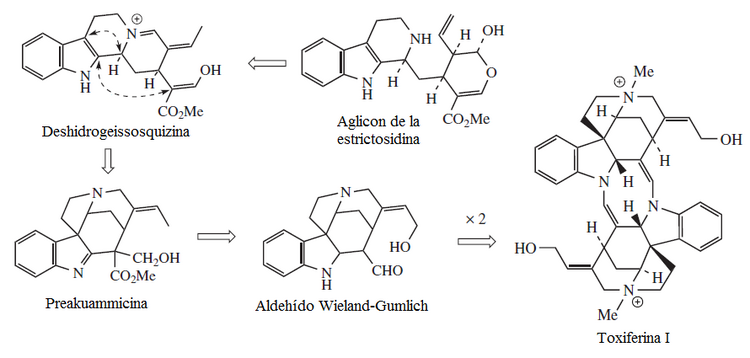
La estrictosidina es la precursora de distintos alcaloides con modificaciones estructurales y formación de intrincados compuestos policíclicos característicos de plantas del orden Gentianales. Se pueden distinguir diversas rutas como la del corinanteal, de la cual surge la quinina; la deshidrogeisosquizina, de la cual se diversifica a la prekuamicina y la catenamina, de donde provienen los yohimbinoides y la ajmalicina.




La transposición y escisión de los anillos del corinanteal produce los esqueletos tipo condifolano:

La dimerización del aldehído de Wieland-Gumlich forma la toxiferina, un alcaloide del curare estricnínico:
Un derivado de la prekuamicina, la estemadenina, puede formar distintos alcaloides tales como la elipticina:


- Cuando la prekuamicina sufre ruptura de anillos con condensación de una unidad adicional de acetato, se forman los alcaloides estricnoides:


La prekuamicina también es precursora de los sistemas tipo andranginina:

La secodina sufre ciclizaciones posteriores para formar los alcaloides de la vinca (Cataranthus). Un metabolito particularmente estudiado de esta ruta es la vinblastina:


Principales estructuras
- Alcaloides tipo camptotecina: Presentan anillos de (1H,4H,12H)-pirano[3',4':6,7]indolizino[1,2-b]quinolina como la Rubescina, camptotecina.
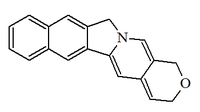 |
| (1H,4H,12H)-pirano[3',4':6,7]indolizino[1,2-b]quinolina |
- Alcaloides indoloquinolizidínicos: Angustina, Deplancheína
 |
| Angustina |
- Alcaloide tipo Corynanthe: Geissosquizina, sitsirikina, Ocrolifuaninas, Usambarinas
 |
 |
| Geissosquizina | Ocrolifuanina A |
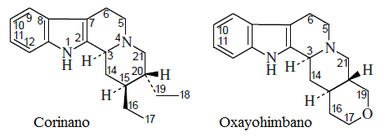
- Alcaloides tipo Ajmalicina: Ajmalicina, oxayohimbano, corinanteína
 |
 |
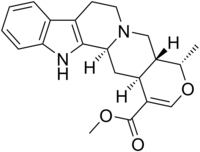 |
| Corinano | Oxayohimbano | Ajmalicina |
- Alcaloides oxindólicos: Rincofilina, Formosanina
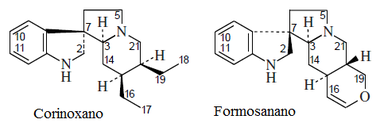

- Alcaloides yohimbinoides: Yohimbina, reserpina, Alstonilina, rescinamina.
- Alcaloides tipo Akuammilina: Akuammilina, equitamina, eripina, aspidodasicarpina, alstofilina, narelina,
 |
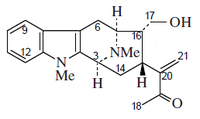 |
| Akuamilano | Macrolina |
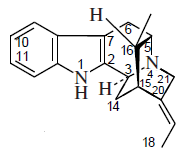
- Alcaloides tipo sarpagina: Sarpagina, vobasina, gardneramina, ervatamina, ervitsina y koumina.Ervatamina, tabernaemontanina
 |
 |
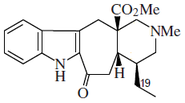 |
| Sarpagano | Akuamidina | Ervatamina |
- Alcaloides tipo ajmalano: Perakina, Raucaffrinolina, ajmalina
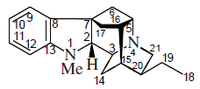
- Alcaloides tipo pleiocarpamina: Pleiocarpamina

- Alcaloides tipo cincona: Este grupo de alcaloides incluye el antimalárico quinina, y contienen un anillo de quinuclidina. Este grupo se clasifica en dos grupos:
Quinina, cinconamina (a) el grupo de la cinconamina, derivado de un precursor tipo corinantina por fisión de N-4 al enlace C-5, y por unión de N-4 a C-17, (b) el grupo de la quinina, el cual contiene un anillo de quinolina generado por la fusión de los enlaces 2,7 seguido de una fusión de N-1 a C-5 del cinconaminal.

 |
 |
| Cinconamina | Quinina |
- Alcaloides tipo estricnina: Se forman a partir de la akuammicina y sufren una posterior condensación aldólica con una unidad de acetil coenzima A. Algunos ejemplos son la Estricnidina, prekuamicina, brucina, estemadenina, estricnina.

- Alcaloides condilofolánicos: Condilocarpina, goniomina

- Alcaloides tipo goniomina: Goniomina
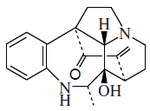
- Alcaloides secodínicos: Secodina y andranginina.

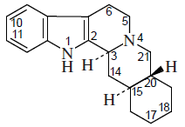
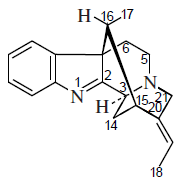
- Alcaloides ibogamínicos: Consiste en una serie de alcaloides que provienen de la fisión de la prekuamicina, en donde se forma la estemadenina y por reacción de Dielsa-Alder se forma un nuevo anillo de ibogamina.

Ejemplos de estos alcaloides son la Catarantina, coronaridina, tabernoxidina.
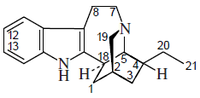 |
| Ibogamina |
Los alcaloides de este grupo incluyen las siguientes variantes estructurales:
- (a) alcaloides anilinoacrílicos, tales como la tabersonina, el cual contiene el grupo metoxicarbonilo en el carbono 16. Los dos sustituyentes de carbono en la posición 20 pueden ser un simple grupo etilo, o pueden estar funcionalizados.

(b) alcaloides que carecen del grupo metoxicarbonilo del carbono 16, como en la aspidospermina. C-18 y C-19 pueden ser un grupo etilo o C-18, el cual puede estar funcionalizado.

(c) alcaloides que contienen un puente éter o lactona entre C-18 y C-21; (d) alcaloides que contienen un puente éter o lactona entre C-18 y C-15; (e) alcaloides que contienen un puente lactona entre C-18 y C-17, y un anillo de dihidro-1,4-oxazina entre N-1 y C-12, como en la obscurinervidina:
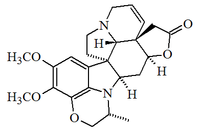 |
| Obscurinervidina |
(f) alcaloides que contienen un enlace adicional entre C-18 y C-2, como en la venalstonina;
 |
| Venalstonina |
(g) alcaloides que contienen un enlace adicional entre C-19 y C-2, como en la vindolinina;
 |
| Vindolinina |
(h) el grupo de la quebrachamina, la cual es derivada de la fisión del enlace 7,21. Estos alcaloides pueden haber perdido el grupo metoxicarbonilo del C-16 como en la quebrachamina o puede conservarse, como en la vincadina. Ejemplos de estos alcaloides son kopsiyunaninas.
 |
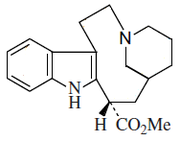 |
| (+)-Quebrachamina | Vincadina |
(i) Dímeros tales como la vinblastina, la vinorebina y la vincristina. (V. Alcaloides de la vinca) (j) alcaloides diversos formados por una gran variedad de procesos, p. ejem. aspidodispermina, banucina, vincatina, razinilama, tricofilina, meloscina, melonina, goniomitina
- Alcaloides kopsánicos: Kopsina, Fruticosina

- Alcaloides tipo lapidilectina y lundurina.
 |
 |
| Lapidilectina B | Lundurina B |
- Alcaloides tipo pandolina: Pandolina, Cleavamina, Pandina, Iboxifilina, Ibofilidina

- Alcaloides piridocarbazólicos: Estos alcaloides se forman por la escisión de la estemadenina y por ciclización sobre el anillo de indol. Ejemplos de estos compuestos son la Olivacina, Elipticina, guatambuina, janetina

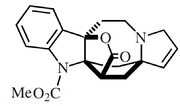
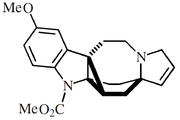
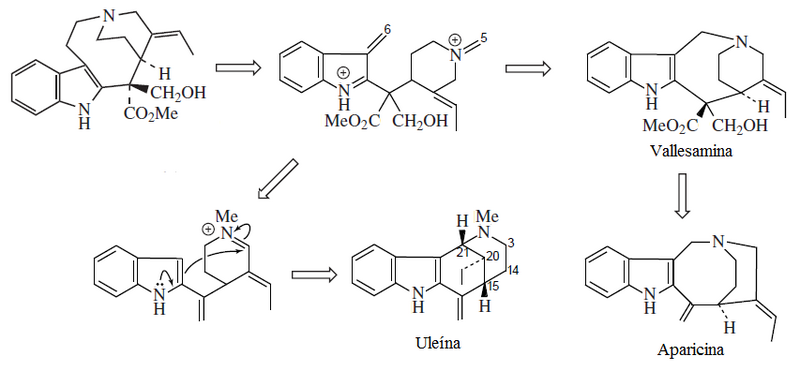
- Alcaloides tipo uleína-dasicarpidano: Ngouniensina, vallesamina, uleína
- Alcaloides tipo conofilidina.

- Alcaloides de Eburna: Eburnamina, cuanzina, Equizozigina, Andrangina y Vallesamidina
El esqueleto de estos alcaloides se generan por transposición del sistema de aspidospermidina, por migración del carbono 21 desde el carbono 7 al carbono 2, fisión del enlace 2,16 y por unión de C-16 a N-1. Estos alcaloides se pueden clasificar en: (a) Vincamina y sus derivados, los cuales retienen el grupo metoxicarbonilo; (b) los alcaloides como la eburnamina y la eburnamenina, el cual tiene una pérdida del grupo éster en C-22; (c) algunos derivados en donde C-18 o C-19 son oxidados como la cuanzina; (d) El grupo de la esquizozigina, el cual contiene un enlace adicional entre C-2 y C-18; (e) Alcaloides relacionados andrangina y vallesamidina, en donde C-21 ha migrado a C-2.
 |
| Eburnamenina |
Caracterización química
- Reactivos generales de alcaloides (mayer, dragendorf, bouchardat, wagner).
- Revelado de CCF con vapor de I2
- Reactivos específicos:
- Reacción de Van Urk: Alcaloides del cornezuelo del centeno + ácido p-dimetilaminobenzaldehído acidificado--> coloración azul.
- Alcaloides de la quina dan fluorescencia azul en la luz UV tras tratamiento con ácido fórmico.
- Sulfato de amonio cérico acidificado con sulfúrico (o fosfórico) --> coloración variable dependiendo del tipo de alcaloide indólico (indol: amarillo; dihidroindol: rojo anaranjado.
Actividad farmacológica
Este tipo de alcaloides derivan en dos sublcases:
- Alcaloides indólicos: presentes en drogas de tipo alucinógeno como haba de calabar. Cornezuelo del centeno, rauwolfia, vincas o nuez vómica
- Quinoleínicos: De acción antimalárica como los presentes en la quina.
Referencias
- ↑ Dewick, P.M. (2009). Medicinal Natural Products. A biosynthetic approach. UK: John Wiley and Sons. ISBN 978-0-470-74168-9.
- ↑ Overman, L.E. and Sworin, M. (1985) in Alkaloids: Chemical and Biological Perspectives, (ed. S.W. Pelletier), Vol. 3, Wiley-Interscience, New York.








