| Benceno | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Benceno | ||
| General | ||
| Fórmula estructural |
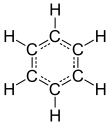 | |
| Fórmula molecular | C6H6 | |
| Identificadores | ||
| Número CAS | 71-43-2[1] | |
| Número RTECS | CY1400000 | |
| ChEBI | 16716 | |
| ChEMBL | CHEMBL277500 | |
| ChemSpider | 236 | |
| PubChem | 241 | |
| UNII | J64922108F | |
| KEGG | C01407 | |
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 878,6 kg/m³; 0,8786 g/cm³ | |
| Masa molar | 781 121 g/mol | |
| Punto de fusión | 278,6 K (5 °C) | |
| Punto de ebullición | 353,2 K (80 °C) | |
| Viscosidad | 0,652 mPa·s (20 °C) | |
| Índice de refracción (nD) | 1,501 | |
| Propiedades químicas | ||
| Solubilidad en agua | 1,79 | |
| Momento dipolar | 0 D | |
| Termoquímica | ||
| ΔfH0gas | 82,93 kJ/mol | |
| ΔfH0líquido | 48,95 kJ/mol | |
| S0líquido, 1 bar | 150 J·mol–1·K–1 | |
| Peligrosidad | ||
| SGA |
   | |
| Punto de inflamabilidad | 262 K (−11 °C) | |
| NFPA 704 |
3
3
2
| |
| Temperatura de autoignición | 834 K (561 °C) | |
| Frases S | S45, S53 | |
| Frases H | H225, H304, H315, H319, H340, H350, H372 | |
| Frases P | P201, P210, P331 | |
| Límites de explosividad | 1.3% - 7.9%[2] | |
| Compuestos relacionados | ||
| Hidrocarburos |
Ciclohexano Naftaleno | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El benceno es un hidrocarburo aromático de fórmula molecular C6H6 (originariamente a él y sus derivados se le denominaban compuestos aromáticos debido a la forma característica que poseen). También es conocido como benzol. En el benceno cada átomo de carbono ocupa el vértice de un hexágono regular, aparentemente tres de las cuatro valencias de los átomos de carbono se utilizan para unir átomos de carbono contiguos entre sí, y la cuarta valencia con un átomo de hidrógeno. Según las teorías modernas sobre los enlaces químicos, tres de los cuatro electrones de la capa de valencia del átomo de carbono se utilizan directamente para formar los enlaces covalentes típicos (2C-C y C-H) y el cuarto se comparte con los de los otros cinco átomos de carbono, obteniéndose lo que se denomina "la nube π (pi)" que contiene en diversos orbitales los seis electrones. El benceno es un líquido incoloro y muy inflamable de aroma dulce (que debe manejarse con sumo cuidado debido a su carácter cancerígeno), con un punto de ebullición relativamente alto.
El benceno se usa en grandes cantidades en los Estados Unidos. Se encuentra en la lista de los 20 productos químicos de mayor volumen de producción. Algunas industrias usan el benceno como punto de partida para manufacturar otros productos químicos usados en la fabricación de plásticos, resinas, nilón y fibras sintéticas como lo es el kevlar y en ciertos polímeros. También se usa benceno para hacer ciertos tipos de gomas, lubricantes, tinturas, detergentes, tóner de impresoras láser,[3] medicamentos y pesticidas. Los volcanes e incendios forestales constituyen fuentes naturales de benceno. El benceno es también un componente natural del petróleo crudo y la gasolina. Se encuentra también en el humo de cigarrillo y otros materiales orgánicos que se han quemado. Puede obtenerse mediante la destilación fraccionada del alquitrán de hulla.
Se suele mostrar, en términos de estructura de Lewis, como un hexágono, plano e indeformable, carente de tensiones de anillo (transanulares), en cuyos vértices se encuentran los átomos de carbono, con tres dobles enlaces y tres enlaces simples en posiciones alternas (1=2, 3=4, 5=6; 6-1, 2-3, 4-5; o bien 1=2-3=4-5=6-1). Esta estructura difería de la de Brønsted y Lowry.
Hay que resaltar que, acorde a los resultados de la espectrofotometría infrarroja, el benceno no posee ni simples ni dobles enlaces, sino un híbrido de resonancia entre ambos, de distancia de enlace promedio entre simple y doble (aproximadamente 1,4 Å). Estos resultados coinciden con la previsión de la TOM (teoría de orbitales moleculares), que calcula una distribución de tres orbitales enlazantes totalmente ocupados. A esta especial estabilidad se le llama aromaticidad y a las moléculas (iones o no, estables o intermedios de reacción) se les llama aromáticas.
Introducción histórica
La molécula de benceno fue descubierta por Faraday en 1825, quien aisló por primera vez a partir del gas de alumbrado el compuesto, de fórmula empírica CH. Fue Eilhard Mitscherlich quien logró medir su masa molecular a partir de su presión de vapor, estableciéndola en 78 u, lo que correspondía a una fórmula molecular C6H6. El compuesto se había obtenido de la goma benjuí, lo que llevó a que se denominase bencina, y posteriormente benceno.
Inicialmente se propusieron formas abiertas (alifáticas) para la cadena de benceno, con dos triples enlaces, sin embargo los datos experimentales que se obtenían a partir de sus reacciones eran contradictorios con estos modelos abiertos, dado que presentaba un número inusualmente bajo de isómeros. Así, por ejemplo, la monobromación del compuesto presentaba un único isómero, al igual que ocurría con la nitración. Por otro lado no respondía a las adiciones habituales de nucleófilos a enlaces múltiples.

Esto llevó a que se propusieran diversas estructuras para comprender estos hechos, como la de Dewar, la de Klaus o la de Kekulé.
Sin embargo, la estructura de Kekulé seguía presentando una incompatibilidad con la malformación 1,2 de la molécula, dado que deberían formarse dos isómeros (isómeros ortobencénicos), uno de ellos con el bromo sobre un doble enlace y el otro con ambos bencenos sobre un enlace simple. Esto llevó a Kekulé a proponer que el benceno alternaba entre dos formas, en las que los enlaces cambiaban continuamente de posición, por lo que únicamente se detectaría un isómero.
Resonancia del benceno
La representación de los tres dobles enlaces se debe a Friedrich Kekulé, quien además fue el descubridor de la estructura anular de dicho compuesto y el primero que lo representó de esa manera.

De todas formas, fue el Premio Nobel de Química, Linus Pauling quien consiguió encontrar el verdadero origen de este comportamiento, la resonancia o mesomería, en la cual ambas estructuras de Kekulé se superponen.

Normalmente se representa como un hexágono regular con un círculo inscrito para hacer notar que los tres dobles enlaces del benceno están deslocalizados, disociados y estabilizados por resonancia. Es decir, no "funcionan" como un doble enlace normal sino que al estar alternados, esto es, uno sí y uno no, proporcionan a la molécula sus características tan especiales. Cada carbono presenta en el benceno hibridación sp2. Estos híbridos se usarán tanto para formar los enlaces entre carbonos como los enlaces entre los carbonos y los hidrógenos. Cada carbono presenta además un orbital Pz adicional perpendicular al plano molecular y con un electrón alojado en su interior, que se usará para formar enlaces π.
Reactividad molecular
La reacción típica del benceno es la de sustitución aromática que sigue dos caminos alternativos:
- Electrofílica (por ataque de un electrófilo)
- De radicales libres (por ataque de un radical libre o átomo libre)
Las reacciones de sustitución aromática más corrientes son las originadas por reactivos electrofílicos. La capacidad del benceno para actuar como un donador de electrones se debe a la polarización del núcleo bencénico. Las reacciones típicas del benceno son las de sustitución. Los agentes de sustitución utilizados con más frecuencia son:
- Cloro.
- Bromo.
- Ácido nítrico.
- Ácido sulfúrico concentrado y caliente.
Halogenación
El cloro y el bromo dan derivados por sustitución de uno o más hidrógenos del benceno, que reciben el nombre de haluros de arilo.
La halogenación está favorecida por las bajas temperaturas y algún catalizador, como el hierro, el tricloruro de aluminio u otro ácido de Lewis, que polariza al halógeno para que se produzca la reacción. En el caso del bromobenceno se utiliza FeBr3 como catalizador.[4]
Sulfonación
Cuando los hidrocarburos bencénicos se tratan con ácido sulfúrico concentrado, que es una mezcla de (H2SO4) y (SO3), se forman compuestos característicos que reciben el nombre ácidos sulfónicos. El electrófilo que reacciona puede ser HSO3+ o SO3.[5] Es la única reacción reversible de las que estamos considerando.[6]
Nitración
El ácido nítrico fumante o una mezcla de ácidos nítrico y sulfúrico, denominada mezcla sulfonítrica, (una parte de ácido nítrico y tres de sulfúrico), produce derivados nitrados, por sustitución. El ácido sulfúrico protona al ácido nítrico que se transforma en el ion nitronio positivo (NO2+) que es el agente nitrante efectivo:
Este proceso se efectúa haciendo reaccionar el benceno con ácido nítrico y usando como catalizador ácido sulfúrico, mezcla que se conoce como sulfonítrica, generándose el ion nitronio NO2+, que actúa como agente electrofílico a una temperatura entre 50 a 60 °C, produciéndose en este proceso el nitro benceno y agua
Combustión
El benceno es inflamable y arde con llama fuliginosa, propiedad característica de la mayoría de los compuestos aromáticos y que se debe a su alto contenido en carbono.
Hidrogenación
El anillo de benceno puede ser reducido a ciclohexano, con hidrogenación catalítica (por ejemplo, usando níquel Raney) a alta presión, manteniendo así la estructura de la cadena cerrada. La reducción parcial se puede llevar a cabo por medio del método de Birch para formar ciclohexadienos.
Síntesis de Friedel y Crafts (alquilación)
El benceno reacciona con los haluros de alquilo, en presencia de cloruro de aluminio anhidro (AlCl3) como catalizador, formando homólogos.
El ataque sobre el anillo bencénico por el ion +CH3 es semejante al realizado por el ion Cl+ en la cloración.
Síntesis de Wurtz–Fittig
Es una modificación de la de Wortz de la serie grasa. Los homólogos del benceno pueden prepararse calentando una solución etérea de un halogenuro de alquilo y otro de arilo con sodio. Este método tiene la ventaja sobre el de Friedel–Crafts, de que se conoce la estructura del producto y puede introducirse fácilmente cadenas largas normales.
- Derivados del benceno. Influencia orientadora de los elementos que sustituyen al benceno.
Cuando se introduce un segundo sustituyente y en un derivado del benceno del tipo C6H5X, la posición que ocupa Y depende del carácter electrónico del grupo X, que ya está presente en el núcleo. Los productos de la reacción pueden ser orto y para o meta disustituidos y eso depende de la velocidad de la reacción de sustitución en cada una de las tres posiciones.
Hay unas reglas de orientación:
- Los grupos de la clase I (dadores de electrones o entregadores) orientan la sustitución a las posiciones orto y para. En esta clase pueden encontrarse alguno de los grupos que siguen, OH, NH2, Cl, Br, I, F, CH2CI, SH, C6H5, etc.
- Los grupos de la clase II (aceptores de electrones) orientan la sustitución a la posición meta. En esta clase pueden incluirse: N02, SO3H, CN, COOH, CHO, etc.
Hay un método sencillo de orientación para los derivados disustituidos que fue establecido por Körner. Frecuentemente es llamado método 2,3,1 de Körner. Se basa en el principio de que la introducción de un tercer sustituyente en un compuesto para proporciona un producto trisustituido, en el isómero orto dos y en el meta tres. Körner aplicó este principio para establecer la orientación de los dibromobencenos isómeros. Nitró cada uno de ellos y examinó el número de productos nitrados. El isómero que dio un solo dibromo-nitrobenceno es el para; el que dio dos derivados nitrados, el orto, y el tercero que dio tres, es el compuesto meta.
Alquilbencenos
Los hidrocarburos como el tolueno, etilbenceno, fenol, etc., tienen carácter alifático y aromático. El benceno es no polar, lo mismo que el metano, siendo cero el momento dipolar de cada uno de estos compuestos. Sin embargo, el tolueno tiene un pequeño momento dipolar (aproximadamente 0,4 D) con la carga negativa sobre el núcleo y la positiva sobre el grupo metilo. Los alquilbencenos experimentan la cloración y bromación, ya sea en el núcleo o en la cadena lateral, según sean las condiciones de la reacción. Para denominar las posiciones relativas del benceno, véase Patrones de sustitución en hidrocarburos aromáticos.
Toxicidad
Respirar niveles de benceno muy altos puede causar la muerte, mientras que niveles bajos pueden causar somnolencia, mareo y aceleración del latido del corazón o taquicardia. Comer o tomar altos niveles de benceno puede causar vómitos, irritación del estómago, mareo, somnolencia o convulsiones y, en último extremo, la muerte.
La exposición de larga duración al benceno se manifiesta en la sangre. El benceno produce efectos nocivos en la médula ósea y puede causar una disminución en el número de hematíes, lo que conduce a padecer anemia. El benceno también puede producir hemorragias y daños en el sistema inmunitario, aumentando así las posibilidades de contraer infecciones por inmunodepresión.
Los efectos nocivos del benceno aumentan con el consumo de bebidas alcohólicas.[7]
Algunos estudios[8] sobre una muestra de mujeres que respiraron altos niveles de benceno durante varios meses han revelado que presentaron menstruaciones irregulares, así como disminución en el tamaño de sus ovarios. No se sabe si la exposición al benceno afecta al feto durante el embarazo. Varios estudios en animales han descrito bajo peso de nacimiento y problemas en la formación de huesos.
El Departamento de Salud y Servicios Sociales de los Estados Unidos (DHHS) ha determinado que el benceno es un reconocido carcinógeno en seres humanos y otros mamíferos lactantes. La exposición de larga duración a altos niveles de benceno en el aire puede producir leucemia,[9] así como cáncer de colon.
En el organismo, el benceno es transformado en productos llamados metabolitos. Ciertos metabolitos pueden medirse en la orina o en las heces. Sin embargo, este examen debe hacerse con celeridad después de la exposición y el resultado del análisis no indica a que concentración de benceno se estuvo expuesto, ya que los metabolitos en la orina pueden originarse a partir de otras fuentes.
Usos del benceno
El benceno se utiliza como constituyente de combustibles para motores, disolventes de grasas, aceites y pinturas; en el grabado fotográfico de impresiones; como intermediario químico en la manufactura de detergentes, explosivos, productos farmacéuticos y pinturas; en la síntesis de otros productos químicos, como el estireno, cumeno (en varias resinas) y ciclohexano (en nailon y fibras sintéticas), en la manufactura de ciertos tipos de caucho, lubricantes y plaguicidas.
Referencias
- ↑ Número CAS
- ↑ Matheson Gas Data Book. «Lower and Upper Explosive Limits for Flammable Gases and Vapors (LEL/UEL)» (en inglés). Matheson Gas Products. p. 443. Archivado desde el original el 30 de septiembre de 2019. Consultado el 2 de octubre de 2016.
- ↑ Benceno es aún más peligroso de lo estimado hasta ahora
- ↑ Griffin, Rodger W.; et al (1981). «Sustitución electrófila aromática», en Química orgánica moderna. Reverte. ISBN 84-291-7210-6.
- ↑ Enrique; et al (1979). «Sulfonación», en Química orgánica. Reverté. ISBN 978-84-291-7015-3.
- ↑ McMurry, John (2006). «Química del benceno: sustitución electrófila aromática» en Química orgánica. Cengage Learning Editores. ISBN 970-686-354-0.
- ↑ «Benceno», en Fichas Internacionales de Seguridad Química Archivado el 18 de diciembre de 2008 en Wayback Machine.. Instituto Nacional de Seguridad e Higiene en el Trabajo. España. Consultado el 24 de junio de 2009.
- ↑ «Resúmenes de Salud Pública - Benceno (Benzene)». 6 de mayo de 2016.
- ↑ El tóner de impresoras laser contiene benceno: Benceno es aún más peligroso de lo estimado hasta ahora
Véase también
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Benceno.
Wikimedia Commons alberga una galería multimedia sobre Benceno.- ATSDR en Español - ToxFAQs™: Benceno Departamento de Salud y Servicios Humanos de EE. UU. (dominio público)
- ATSDR en Español - Resumen de Salud Pública: Benceno Departamento de Salud y Servicios Humanos de EE. UU. (dominio público)
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del benceno.















