La carbometalación es una reacción organometálica que implica la adición nucleófila a alquenos y alquinos de una amplia gama de reactivos organometálicos tales como compuestos litiados, compuestos organometálicos de cobre y reactivos de Grignard. A diferencia de la hidrometalación, los metales son bastante electropositivos (alcalinos, Al, Cu, Mg, etc) los que dan esta reacción.[1] Aquí se muestra un esquema general de carbometalación de alquinos:

La adición puede producir isómeros cis o trans y, además, con alquinos asimétricos, el compuesto organometálico se puede adicionar por dos vías diferentes, por lo tanto, el control de la regioselectividad es importante. Una vez se produce la adición del compuesto organometálico, el metal se sustituye por un electrófilo (E+).
Una carbometalación básicamente es cualquier reacción en la que un enlace carbono-metal (C-M) reacciona con un enlace π carbono-carbono (C=C) para producir un nuevo enlace σ carbono-carbono (C-C) y un enlace σ carbono-metal (C-M). El enlace carbono-metal resultante puede sufrir más reacciones de carbometalización (oligomerización o polimerización, como la polimerización de Ziegler-Natta) o puede reaccionar con una variedad de electrófilos, incluidos reactivos halogenantes, carbonilos, oxígeno y sales inorgánicas para producir diferentes reactivos organometálicos. Algunos metales prefieren dar el producto de adición-anti con alta selectividad y otros producen el producto de adición-syn. El resultado de los productos de adición syn y anti está determinado por el mecanismo de la carbometalación.[2]
En función del metal empleado, tendremos una carboaluminación (cuando se emplea un compuesto organometálico de aluminio), una carbolitiación (con un organolitiado), una carbomagnesación (organomagnesiano), una carbozincación (organozinc), una carbopaladación (organopaladio)...
Aplicaciones
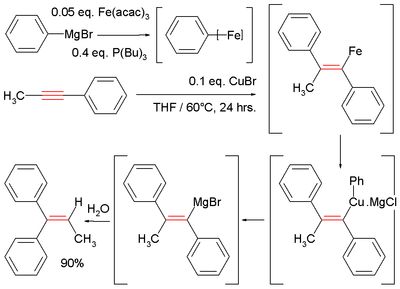
En un estudio se hace reaccionar metilfenilacetileno con bromuro de fenilmagnesio obteniéndose bromuro de vinil magnesio que se inactivó con agua:[3]
Otro ejemplo de este tipo de reacción es una ruta alternativa al tamoxifeno a partir de difenilacetileno y etillitio:[4]

El electrófilo aquí es el borato de triisopropilo que forma el ácido borónico R-B(OH)2. El segundo paso para la síntesis del tamoxifeno es una reacción de Suzuki.
Referencias
- ↑ Elschenbroich, Christoph (2005). Organometallics. Willey-VCH. ISBN 978-3-527-29390-2.
- ↑ Negishi, Ei-ichi; Tan, Ze (2005), «Diastereoselective, Enantioselective, and Regioselective Carboalumination Reactions Catalyzed by Zirconocene Derivatives», Metallocenes in Regio- and Stereoselective Synthesis: -/-, Topics in Organometallic Chemistry (Springer Berlin Heidelberg): 139-176, ISBN 9783540314523, doi:10.1007/b96003.
- ↑ Arylmagnesiation of Alkynes Catalyzed Cooperatively by Iron and Copper Complexes Eiji Shirakawa, Takafumi Yamagami, Takahiro Kimura, Shigeru Yamaguchi, and Tamio Hayashi J. Am. Chem. Soc.; 2005; 127(49) pp 17164 - 17165; (Communication) doi 10.1021/ja0542136
- ↑ Carbolithiation of Diphenylacetylene as a Stereoselective Route to (Z)-Tamoxifen and Related Tetrasubstituted Olefins Neola F. McKinley and Donal F. O'Shea J. Org. Chem.; 2006; 71(25) pp 9552 - 9555; (Note) doi 10.1021/jo061949s








