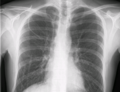
| Central venous catheter | ||
|---|---|---|
 Diagram showing a non-tunneled central line inserted into the right subclavian vein. | ||
| Clasificación y recursos externos | ||
| MeSH | D002405 | |
Un catéter venoso central (CVC), también conocido como vía central, vía venosa central o catéter de acceso venoso central, es un dispositivo con forma de tubo que se coloca en una vena de gran tamaño con el objetivo de permitir el acceso al sistema venoso a profesionales de la salud. La colocación de estos catéteres de mayor calibre en venas ubicadas a nivel central a menudo es necesaria en pacientes enfermos críticos o en aquellos que requieren de la administración de terapias intravenosas prolongadas, para un acceso al sistema vascular más fiable. Estos catéteres se colocan comúnmente en las venas del cuello (vena yugular interna), el pecho (vena subclavia o vena axilar), la ingle (vena femoral) o a través de las venas de los brazos (también conocida como vía PICC o catéteres centrales insertados periféricamente).
Las vías centrales se utilizan para administrar medicamentos que no se pueden tomar por vía oral o que dañarían una vena periférica más pequeña, así como para obtener análisis de sangre (específicamente, con el objetivo de hallar la saturación venosa central), administrar líquidos o transfusiones sanguíneas para reanimación de gran volumen, así como medir la presión venosa central.[1][2] Los catéteres utilizados suelen ser de 15 a 30 centímetros de longitud, fabricados en silicona o poliuretano, y poseen uno o varios lúmenes de infusión.[3]
Usos médicos


Las siguientes son las principales indicaciones para el uso de catéteres venosos centrales:[3]
- Acceso venoso periférico difícil: se pueden colocar catéteres venosos centrales cuando es difícil obtener o mantener el acceso venoso periférico (por ejemplo, por obesidad, por la presencia de venas con cicatrices de canulaciones anteriores o en pacientes agitados).
- Administración de ciertos medicamentos o líquidos: algunos medicamentos como vasopresores (p. Ej., norepinefrina, vasopresina, fenilefrina, etc.), agentes quimioterapéuticos o soluciones hipertónicas pueden resultar dañinos para las venas periféricas y a menudo requieren de la colocación de una vía central. Además, los catéteres con múltiples lúmenes pueden facilitar la administración simultánea de varios medicamentos parenterales.
- Terapias intravenosas prolongadas: los medicamentos parenterales que deben administrarse durante períodos prolongados (más de unos pocos días), como la nutrición parenteral a largo plazo o antibióticos intravenosos se administran a través de una vía central.
- Tratamiento especializado: intervenciones como hemodiálisis, plasmaféresis, estimulación cardíaca transvenosa y monitorización hemodinámica invasiva (por ejemplo en casos de cateterismo de la arteria pulmonar) requieren de la utilización de un acceso venoso central.
No existen contraindicaciones absolutas para el uso de catéteres venosos centrales.[3] Las contraindicaciones relativas incluyen alteraciones patológicas de la coagulación, traumatismo o infección local en el sitio de colocación, o sospecha de lesión vascular proximal.[4] Sin embargo, existen riesgos y complicaciones asociados a la su uso.
Complicaciones
La inserción de una vía central puede causar varias complicaciones. El beneficio que se espera de su uso debe superar el riesgo de esas complicaciones.
Neumotórax
La incidencia de neumotórax es mayor con el cateterismo de la vena subclavia debido a su proximidad anatómica al ápice del pulmón. En el caso de la cateterización de la vena yugular interna, el riesgo de neumotórax se minimiza mediante el uso de guía ecográfica. Para los médicos experimentados, la incidencia de neumotórax es de aproximadamente 1.5 a 3.1%. El Instituto Nacional de Salud y Excelencia Clínica (Reino Unido) y otras organizaciones médicas recomiendan el uso rutinario de la ecografía para minimizar las complicaciones.[5]
Si se sospecha un neumotórax, se debe obtener una radiografía de tórax en posición vertical del paciente. Se prefiere una radiografía de tórax en posición vertical porque el aire libre migrará al vértice del pulmón, donde se visualiza fácilmente. Por supuesto, esto no siempre es posible, especialmente en pacientes críticamente enfermos en la unidad de cuidados intensivos. Las radiografías obtenidas en decúbito supino no detectan entre el 25 y el 50% de los neumotórax.[6] Sin embargo, la ecografía puede usarse como método de detección en personas demasiado enfermas para obtener imágenes en posición vertical.[3]
Perforación vascular
La perforación de un vaso de importancia por un catéter es una complicación temida y potencialmente mortal de las vías centrales. Afortunadamente, la incidencia de estos eventos es extremadamente rara, especialmente cuando las vías se colocan con ayuda ecográfica. La perforación accidental de la arteria carótida es una complicación posible que puede ocurrir durante la colocación una vía central en la vena yugular interna. Esto ocurre con una frecuencia aproximada del 1% cuando se hace mediante el guiado ecográfico. Sin embargo, tiene una incidencia del 0,5 a 11% cuando se utiliza a través de un abordaje anatómico.[7] Si la carótida se perfora accidentalmente y se inserta un catéter en la arteria, el catéter debe dejarse en su lugar y se debe notificar a un cirujano vascular porque retirarlo puede ser mortal para el paciente.[3][8]
Infecciones del torrente sanguíneo relacionadas con el catéter
Todos los catéteres pueden introducir bacterias en el torrente sanguíneo. Esto puede resultar en infecciones graves que pueden ser fatales hasta en un 25% de los casos.[9] El problema de las infecciones del torrente sanguíneo asociadas a la vía central (CLABSI, por sus siglas en inglés) ha ganado atención en los últimos años,[10] ya que pueden causar una gran morbilidad y muertes, y aumentan el gasto de la atención médica.
Los microbios pueden acceder al torrente sanguíneo a través de un catéter central de varias formas. Rara vez se introducen mediante transfusiones contaminadas. También pueden obtener acceso al lumen del catéter a través de puntos de rotura. Sin embargo, el método por el cual la mayoría de los organismos obtienen acceso es migrando a lo largo de la parte del catéter que recorre el tejido subcutáneo hasta que alcanzan la parte del catéter en la vena. Además, las bacterias presentes en la sangre pueden adherirse a la superficie del catéter, transformándolo en un foco de infección.[3]
Si se sospecha una infección de la vía central en una persona, frecuentemente se realizan hemocultivos tanto del catéter como de una vena en otra parte del cuerpo. Si el cultivo de la línea central desarrolla bacterias mucho antes (>2 horas) que en el otro sitio de la vena, es probable que la línea esté infectada. El hemocultivo cuantitativo es aún más preciso, pero este método no está siempre disponible.[11]
Los antibióticos casi siempre se administran tan pronto como se sospecha que un paciente tiene una infección del torrente sanguíneo relacionada con el catéter. Sin embargo, esto debe ocurrir después de la extracción de hemocultivos; de lo contrario, es posible que no se identifique el organismo culpable. Los organismos más comunes que causan estas infecciones son los estafilococos coagulasa negativos como el Staphylococcus epidermidis.[3] Las infecciones que provocan bacteriemia por Staphylococcus aureus requieren de la extracción del catéter y antibióticos. Si se retira el catéter sin administrar antibióticos, el 38% de las personas aún pueden desarrollar endocarditis.[12] Una revisión sistemática encontró evidencia de que en pacientes con cáncer, puede no haber beneficio de administrar antibióticos antes de insertar un catéter venoso central a largo plazo para prevenir infecciones relacionadas con catéteres Gram positivos.[13] Sin embargo, lavar el catéter con una solución que contenga un antibiótico y heparina puede reducir las infecciones relacionadas con el catéter en esta población, más probablemente cuando el riesgo de infección es alto.[13]
En una guía de práctica clínica, el Centers for Disease Control and Prevention estadounidense recomienda no realizar cultivos de rutina de las vías venosas centrales al retirarlas.[14] La guía hace varias otras recomendaciones para prevenir infecciones de la vía.[14]
Para prevenir infecciones, se recomienda una limpieza rigurosa del sitio de inserción del catéter. La solución de povidona yodada se usa a menudo para tal limpieza, pero la clorhexidina parece ser dos veces más efectiva que el yodo.[15] La sustitución rutinaria de las vías no consigue prevenir las infecciones más eficazmente.[16] El CDC hace una gran cantidad de recomendaciones con respecto a la reducción del riesgo de infección de CVC, que incluyen:[17]
- El sitio preferido de inserción, desde el punto de vista de la prevención de infecciones, es la vena subclavia y, en general, se evita la vena femoral si es posible.
- No hay una recomendación clara para un sitio de catéter tunelizado en las guías.
- La selección de catéteres debe incluir aquellos con los puertos mínimos para lograr el objetivo clínico.
- Se requieren guantes estériles para la colocación del catéter, así como paños estériles de cuerpo entero, gorro, mascarilla y guantes.
- El sitio del catéter debe controlarse visualmente y con palpación (con vendaje) de forma regular para evaluar la presencia de infección.
- Sin embargo, es aceptable utilizar guantes limpios, no esterilizados, para cambiar el apósito de los catéteres intravasculares.
- Tanto la clorhexidina como la povidona yodada son desinfectantes de la piel aceptables, aunque se prefiere la clorhexidina.
- Para los sitios de CVC a corto plazo, los apósitos deben cambiarse al menos cada siete días para los apósitos transparentes y cada dos días para los apósitos de gasa.
- Para catéteres implantados o tunelizados a largo plazo, los apósitos no deben cambiarse más de una vez por semana, a menos que estén sucios o sueltos.
- No se recomienda la extracción y la sustitución de un catéter venoso central. Si bien los catéteres de vía central deben retirarse tan pronto como ya no sean necesarios, no se ha demostrado que la extracción y la sustitución programados, ya sea sobre una guía o con un nuevo sitio de punción, sean beneficiosos para prevenir infecciones.
- Los apósitos impregnados con medicamentos pueden reducir el riesgo de contraer una infección del torrente sanguíneo relacionada con el catéter.[18]
- No hay pruebas concluyentes de si un intervalo más largo de cambio de apósitos para los dispositivos de acceso venoso central se asocia con más o menos infecciones.[19]
- No está claro si limpiar los antisépticos de la piel o sin limpiar la piel puede reducir la tasa de infecciones del torrente sanguíneo relacionadas con el catéter.[20]
Oclusión

En ocasiones, los catéteres venosos pueden quedar ocluidos por torceduras en el catéter, reflujo de sangre en el catéter que conduce a trombosis o infusión de materiales insolubles que forman precipitados. Sin embargo, la trombosis es la causa más común de oclusión de la vía central y ocurre hasta en un 25% de los catéteres.[3]
Los CVC son un factor de riesgo para la formación de coágulos de sangre (trombosis venosa), incluyendo cuando trombosis venosa profunda de los miembros superiores.[22][23] Se cree que este riesgo se debe a la activación de sustancias coagulantes en la sangre por un traumatismo en la vena durante la colocación.[24] El riesgo de coágulos de sangre es mayor en una persona con cáncer, ya que el cáncer también es un factor de riesgo de coágulos de sangre por sí mismo. Hasta dos tercios de los pacientes con cáncer con vías centrales muestran evidencia de trombosis asociada al catéter.[3] Sin embargo, la mayoría de los casos (más del 95%) pasan desapercibidos. La mayoría de los casos sintomáticos se observan con la colocación de catéteres en la vena femoral (3,4%) o catéteres centrales insertados periféricamente (3%).[3] Se ha demostrado que los fármacos anticoagulantes como la heparina y el fondaparinux reducen la incidencia de coágulos de sangre, específicamente de trombosis venosa profunda, en una persona con cáncer con vías centrales.[25] Además, los estudios sugieren que el uso a corto plazo de CVC en la vena subclavia tiene menos probabilidades de estar asociado con coágulos de sangre que los CVC colocados en la vena femoral en pacientes sin cáncer.[2]
En el caso de oclusión no trombótica (por ejemplo, formación de precipitados), se puede utilizar ácido diluido para restaurar la permeabilidad del catéter. Se suele utilizar una solución de ácido clorhídrico. Las infusiones que contienen una cantidad significativa de lípidos, como la nutrición parenteral total (TPN) o el propofol, también son propensas a la oclusión con el tiempo. En estos casos, la permeabilidad a menudo se puede restaurar mediante la infusión de una pequeña cantidad de etanol al 70%.[3]
Colocación incorrecta
La colocación incorrecta del CVC es más común cuando la anatomía de la persona es diferente o cuando se ha producido una lesión o una cirugía anterior que puede haber modificado la localización de ciertas estructuras de la zona.[24]
Los CVC se pueden colocar por error en una arteria durante la inserción (por ejemplo, la arteria carótida o la arteria vertebral cuando se coloca en el cuello, o la arteria femoral común cuando se coloca en la ingle). Este error se puede identificar rápidamente mediante un tubo especial que puede mostrar la presión del catéter (ya que las arterias tienen una presión más alta que las venas). Además, el envío de muestras de sangre para determinar la acidez, el oxígeno y el contenido de dióxido de carbono (pH, pO2, pCO2 respectivamente) puede mostrar las características de la sangre de una arteria (pH/pO2 más alto, pCO2 más bajo) o vena (pH/pO más bajo, pCO 2 más alto).[1]
Durante la colocación de la vía central en la vena subclavia, el catéter puede introducirse accidentalmente en la vena yugular interna del mismo lado en lugar de en la vena cava superior. Cuando existen sospechas de que esto puede haberse dado lugar, se realiza una radiografía de tórax después de la inserción para descartar esta posibilidad.[26] La punta del catéter también se puede desviar hacia la vena subclavia contralateral (lado opuesto) en el cuello, en lugar de hacia la vena cava superior.
Embolia gaseosa venosa
La entrada de aire en la circulación venosa tiene el potencial de causar una embolia gaseosa venosa. Aunque se trata de una complicación poco común de la colocación de un CVC; sin embargo, puede ser letal. El volumen y la velocidad de entrada de aire determinan el efecto que tendrá una embolia gaseosa en un paciente. Este proceso puede resultar fatal cuando se introducen al menos 200 a 300 mililitros de aire en unos pocos segundos.[27] Las consecuencias de esto incluyen: accidente cerebrovascular embólico agudo (por aire que pasa a través de un foramen oval permeable), edema pulmonar e insuficiencia cardíaca derecha aguda (por aire atrapado en el ventrículo derecho) que puede provocar un shock cardiogénico.[3]
La presentación clínica de una embolia gaseosa venosa puede ser silenciosa. En los que presentan síntomas, los síntomas más comunes son dificultad para respirar y tos de aparición repentina. Si la presentación es grave, el paciente puede volverse rápidamente hipotenso y mostrar un nivel alterado de conciencia debido al shock cardiogénico. También se pueden observar síntomas de un accidente cerebrovascular agudo.[3]Marino's, The ICU Book, 4th Ed.</ref> La ecocardiografía se puede utilizar para visualizar el aire que se ha quedado atrapado en las cavidades del corazón.[27] Si se sospecha una gran embolia gaseosa, se puede colocar una jeringa en la tapa del catéter y extraer el paquete en un intento de eliminar el aire de la circulación. El paciente también puede colocarse en decúbito lateral izquierdo. Se cree que esta posición ayuda a aliviar el aire atrapado en el ventrículo derecho.[3]
Inserción
Antes de la inserción, primero se evalúa al paciente mediante la revisión de los análisis de laboratorio pertinentes y la indicación de la colocación del CVC, con el fin de minimizar los riesgos y las complicaciones del procedimiento. A continuación, se limpia el área de piel sobre el sitio de inserción planificado y se aplica un anestésico local si es necesario. La ubicación de la vena se identifica mediante puntos de referencia o con el uso de un dispositivo de ultrasonido. Se introduce una aguja hueca a través de la piel hasta que se aspira sangre. El color de la sangre y la velocidad de su flujo ayudan a distinguirla de la sangre arterial (lo que puede sugerir que una arteria se ha perforado accidentalmente). En América del Norte y Europa, el uso del ultrasonido representa ahora el gold standard para el acceso y colocación de vías venosas centrales, con un uso cada vez menor de técnicas tradicionales de referencia.[28][29] La evidencia reciente muestra que la guía ecográfica para el cateterismo de la vena subclavia conduce a una reducción de los eventos adversos.[30][31][32]
Luego, la línea se inserta usando la técnica de Seldinger: se pasa una guía roma a través de la aguja y luego se retira la aguja. Se puede introducir un dispositivo de dilatación sobre el alambre guía para aumentar el diámetro. Finalmente, la propia línea central se pasa por encima del alambre guía, que luego se retira. Se aspiran todos los lúmenes de la vía (para asegurarse de que estén colocados dentro de la vena) y se lavan con solución salina o heparina.[1] Posteriormente, se puede realizar una radiografía de tórax para confirmar que la vía está colocada dentro de la vena cava superior y que no se causó neumotórax accidentalmente. En radiografías anteroposteriores, una punta de catéter entre 55 y 29 mm por debajo del nivel de la carina se considera una ubicación aceptable.[33] El seguimiento electromagnético se puede utilizar para verificar la ubicación de la punta y proporcionar una guía durante la inserción, evitando la necesidad de rayos X posteriormente.
-
Un catéter venoso central fijado a la piel con sutura.
-
Radiografía de tórax con catéter en vena subclavia derecha
-
El contorno de la vena cava superior en una radiografía de tórax está etiquetado a la izquierda.
Flujo del catéter
Ecuación de Hagen-Poiseuille
La ecuación de Hagen-Poiseuille describe las propiedades del flujo a través de un tubo rígido.[34] La ecuación se muestra a continuación:
La ecuación muestra que el caudal (Q) a través de un tubo rígido es función del radio interior (r), la longitud del tubo (L) y la viscosidad del fluido (μ). El flujo está directamente relacionado con la cuarta potencia del radio interior del tubo, e inversamente relacionado con la longitud del tubo y la viscosidad del fluido. Esta ecuación se puede utilizar para comprender las siguientes observaciones vitales con respecto a los catéteres venosos: que el radio interno de un catéter tiene un impacto mucho mayor en la velocidad de flujo que la longitud del catéter o la viscosidad del fluido, y que para una infusión rápida, un catéter más corto y de gran calibre es óptimo porque proporcionará el mayor caudal.[3]
Tipos

Hay varios tipos de catéteres venosos centrales; estos se pueden subdividir por sitio (donde se inserta el catéter en el cuerpo) así como por el tipo específico de catéter utilizado.[35]
Por sitio
Catéter venoso central percutáneo (CVC)
Se inserta un catéter venoso central percutáneo, o CVC, directamente a través de la piel. Se utiliza la vena yugular, subclavia o femoral interna o externa. Se utiliza con mayor frecuencia en pacientes críticamente enfermos. El CVC se puede utilizar durante días o semanas y el paciente debe permanecer en el hospital. Por lo general, se mantiene en su lugar con suturas o un dispositivo de sujeción fabricado.[36] Los catéteres de uso común incluyen los catéteres de Quinton .
Catéteres centrales de inserción periférica (PICC)

Un catéter central insertado periféricamente, o línea PICC (pronunciado "pico"), es un catéter venoso central insertado en una vena del brazo (a través de las venas basílica o cefálica) en lugar de una vena en el cuello o el pecho. La vena basílica suele ser un mejor objetivo para la canulación que la vena cefálica porque es más grande y recorre un trayecto más recto a través del brazo. La punta del catéter se coloca en la vena cava superior.[1] Los catéteres PICC tienen un diámetro más pequeño que los catéteres centrales, ya que se insertan en venas periféricas más pequeñas y son mucho más largos que los catéteres venosos centrales (50-70 cm frente a 15-30 cm). Por lo tanto, la velocidad del flujo de líquido a través de las líneas PICC es considerablemente más lenta que las líneas centrales, lo que las hace inadecuadas para la reanimación rápida con líquidos de gran volumen. Los PICC se pueden ocluir fácilmente y no pueden usarse con dilantin IV.[36]
Sin embargo, las líneas PICC pueden ser preferibles por varias razones: pueden proporcionar acceso venoso hasta por un año, y permiten un alta hospitalaria con la implantación del PICC, evitan las complicaciones de la colocación de la vía central (p. ej.: neumotórax o canulación arterial accidental), son relativamente fáciles de colocar bajo guía ecográfica y causan menos molestias que las vías centrales.[3] Los catéteres PICC se pueden insertar al lado de la cama, en el hogar o en un entorno de radiología. Estas se fijan en su posición mediante suturas o a través de un dispositivo de sujeción fabricado.[36]
Catéter venoso central subcutáneo o tunelizado
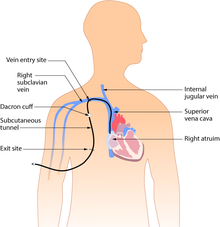
Los catéteres tunelizados se insertan debajo de la piel desde el sitio de inserción hasta un sitio de salida alejado del lugar original, donde el catéter y sus accesorios emergen de debajo de la piel. El sitio de salida generalmente se encuentra en el pecho, lo que hace que los puertos de acceso sean menos visibles que los catéteres que sobresalen directamente del cuello. Pasar el catéter debajo de la piel ayuda a prevenir infecciones y proporciona estabilidad. La inserción es un procedimiento quirúrgico en el que el catéter se tuneliza por vía subcutánea debajo de la piel en el área del tórax. Los catéteres tunelizados de uso común incluyen los catéteres Hickman y Groshong o Broviac y también pueden denominarse con estos nombres.
Un catéter tunelizado puede permanecer insertado durante meses o años. Estos tipos de CVC tienen una tasa de infección baja debido a la presencia del manguito de Dacron, un manguito antimicrobiano que rodea el catéter cerca del sitio de entrada, que se recubre con una solución antimicrobiana y mantiene el catéter en una posición fija después de dos o tres semanas de inserción.[36]
Catéter venoso central implantado (puerto implantado, port-a-cath)



Un catéter venoso central implantado, también llamado catéter de puerto o port-a-cath, es similar a un catéter tunelizado, pero se deja completamente debajo de la piel y es accesible a través de un puerto. Los medicamentos se inyectan a través de la piel en el catéter. Algunos puertos implantados contienen un pequeño depósito que se puede rellenar de la misma forma. Después de llenarse, el depósito libera lentamente el medicamento en el torrente sanguíneo. Los puertos de infusión implantados quirúrgicamente se colocan debajo de la clavícula (fosa infraclavicular), con el catéter insertado en el corazón (aurícula derecha) a través de una vena grande. Una vez implantado, se accede al puerto a través de una aguja con punta de Huber sin núcleo. El conjunto de la aguja incluye un tramo corto de tubo y una cánula que se inserta directamente a través de la piel. El médico y el paciente pueden optar por aplicar un anestésico tópico antes de acceder al puerto. Los puertos se pueden utilizar para medicamentos, quimioterapia y muestras de sangre. Como los puertos están ubicados completamente debajo de la piel, son más fáciles de mantener y tienen un menor riesgo de infección que los catéteres CVC o PICC.[1] Un puerto implantado es menos molesto que un catéter tunelizado o una línea PICC, requiere poco cuidado diario y tiene menos impacto en las actividades diarias del paciente. El acceso al puerto requiere equipo y capacitación especializados.
Los puertos se utilizan típicamente en pacientes que requieren acceso venoso periódico durante un curso prolongado de terapia, luego se enjuagan regularmente hasta que se extraen quirúrgicamente. Si se requiere un acceso venoso con frecuencia durante un período corto, se usa con mayor frecuencia un catéter con acceso externo.[1]
Tipos de catéter
Catéter de triple luz
El catéter más utilizado para el acceso venoso central es el catéter de triple luz.[3]Marino's, The ICU Book, 4th Ed.</ref> Se prefieren (particularmente en la UCI) por sus tres canales de infusión que permiten administrar múltiples terapias simultáneamente. Se dimensionan utilizando la escala francesa, con el tamaño 7 francés comúnmente utilizado en adultos. Estos catéteres suelen tener un canal de calibre 16 y dos canales de calibre 18.[3] Contrariamente a la escala francesa, cuanto mayor es el número de calibre, menor es el diámetro del catéter. Aunque estos catéteres poseen un puerto de calibre 16, el flujo es considerablemente más lento de lo que cabría esperar a través de una vía intravenosa periférica de calibre 16 debido a la longitud más larga del catéter venoso central. Es importante señalar que el uso de múltiples canales de infusión no aumenta el riesgo de infecciones del torrente sanguíneo relacionadas con el catéter.[37]
Catéter de hemodiálisis
Los catéteres de hemodiálisis son catéteres de gran diámetro (hasta 16 French o 5,3 mm) capaces de alcanzar velocidades de flujo de entre 200 y 300 ml/min, que son necesarias para mantener las altas velocidades de flujo de la hemodiálisis. Hay dos canales: uno se usa para llevar la sangre del paciente a la máquina de diálisis, mientras que el otro se usa para devolver la sangre al paciente. Estos catéteres se colocan típicamente en la vena yugular interna.[3]
Vainas introductoras
Las vainas introductoras son catéteres grandes (8 a 9 French) que se colocan típicamente para facilitar el paso de dispositivos vasculares temporales como los catéteres de la arteria pulmonar. Primero se coloca la vaina introductora y luego se enrosca el dispositivo a través de la vaina y dentro del vaso. Estos catéteres también pueden servir como dispositivos independientes para una infusión rápida dado su gran diámetro. Cuando se combina con un sistema de infusión presurizado, se alcanzan velocidades de flujo de 850 ml / min.[3]
Cuidado habitual del catéter

El catéter se mantiene en su lugar mediante un apósito adhesivo, una sutura o una grapa que se cubre con un apósito oclusivo. El enjuague regular con solución salina o una solución que contenga heparina mantiene la vía abierta y previene la formación de coágulos de sangre. No hay evidencia de que la heparina sea mejor que la solución salina para prevenir los coágulos de sangre.[38] Ciertas líneas están impregnadas con antibióticos, sustancias que contienen plata (específicamente sulfadiazina de plata) y/o clorhexidina para reducir el riesgo de infección.[39]
Para vías centrales a largo plazo se utilizan con frecuencia los catéteres Hickman, que requieren de pinzas para asegurarse de que la válvula esté cerrada; así como los catéteres Groshong, que tienen una válvula que se abre cuando se extrae o infunde líquido y permanece cerrada cuando no se usa. Las vías de Hickman también tienen un "manguito" debajo de la piel, para prevenir la migración bacteriana.[cita requerida] El manguito también provoca el crecimiento de tejido hacia el interior del dispositivo para una sujeción a largo plazo.
Referencias
- ↑ a b c d e f McKean, Sylvia; Ross, John; Dressler, Daniel; Brotman, Daniel; Ginsburg, Jeffrey (2012). Principles and practice of hospital medicine. New York: McGraw-Hill. ISBN 978-0071603898.
- ↑ a b «Central venous access sites for the prevention of venous thrombosis, stenosis and infection». The Cochrane Database of Systematic Reviews (3): CD004084. March 2012. PMC 6516884. PMID 22419292. doi:10.1002/14651858.CD004084.pub3.
- ↑ a b c d e f g h i j k l m n ñ o p q r s Marino's, The ICU Book, 4th Ed (en inglés).
- ↑ Tse, Audrey; Schick, Michael A. (2020), «Central Line Placement», StatPearls (StatPearls Publishing), PMID 29262231, consultado el 11 de marzo de 2020.
- ↑ National Institute for Health and Clinical Excellence (September 2002). «Technology appraisal: the clinical effectiveness and cost effectiveness of ultrasonic locating devices for the placement of central venous lines». Archivado desde el original el 20 de octubre de 2014. Consultado el 1 de junio de 2008.
- ↑ «A prospective comparison of supine chest radiography and bedside ultrasound for the diagnosis of traumatic pneumothorax». Academic Emergency Medicine 12 (9): 844-9. September 2005. PMID 16141018. doi:10.1197/j.aem.2005.05.005.
- ↑ «Does ultrasound imaging before puncture facilitate internal jugular vein cannulation? Prospective randomized comparison with landmark-guided puncture in ventilated patients». Journal of Cardiothoracic and Vascular Anesthesia 16 (5): 572-5. October 2002. PMID 12407608. doi:10.1053/jcan.2002.126950.
- ↑ «Marino's, The ICU Book, 4th Ed» (en inglés). Archivado desde el original el 1 de julio de 2014. Consultado el 2 de septiembre de 2021.
- ↑ «Guidelines for the prevention of intravascular catheter-related infections». Clinical Infectious Diseases 52 (9): e162-93. May 2011. PMC 3106269. PMID 21460264. doi:10.1086/344188.
- ↑ «Taurolidine-citrate-heparin catheter lock solution reduces staphylococcal bacteraemia rates in haemodialysis patients». QJM : Monthly Journal of the Association of Physicians 107 (12): 995-1000. December 2014. PMID 24939191. doi:10.1093/qjmed/hcu128.
- ↑ «Meta-analysis: methods for diagnosing intravascular device-related bloodstream infection». Annals of Internal Medicine 142 (6): 451-66. March 2005. PMID 15767623. doi:10.7326/0003-4819-142-6-200503150-00011.
- ↑ «Staphylococcus aureus bacteremia and endocarditis associated with a removable infected intravenous device». The American Journal of Medicine 63 (2): 253-6. August 1977. PMID 888847. doi:10.1016/0002-9343(77)90239-X.
- ↑ a b «Prophylactic antibiotics for preventing Gram positive infections associated with long-term central venous catheters in oncology patients». The Cochrane Database of Systematic Reviews (11): CD003295. November 2013. PMC 6457614. PMID 24277633. doi:10.1002/14651858.cd003295.pub3.
- ↑ a b «Guidelines for the prevention of intravascular catheter-related infections. Centers for Disease Control and Prevention». MMWR. Recommendations and Reports 51 (RR-10): 1-29. August 2002. PMID 12233868.
- ↑ «Chlorhexidine-based antiseptic solution vs alcohol-based povidone-iodine for central venous catheter care». Archives of Internal Medicine 167 (19): 2066-72. October 2007. PMID 17954800. doi:10.1001/archinte.167.19.2066.
- ↑ «A controlled trial of scheduled replacement of central venous and pulmonary-artery catheters». The New England Journal of Medicine 327 (15): 1062-8. October 1992. PMID 1522842. doi:10.1056/NEJM199210083271505.
- ↑ Barash. Clinical Anesthesia, 7th edition. Pages 1602-1603.
- ↑ «Dressings and securement devices for central venous catheters (CVC)». The Cochrane Database of Systematic Reviews (9): CD010367. September 2015. PMC 6457749. PMID 26358142. doi:10.1002/14651858.CD010367.pub2.
- ↑ Gavin, Nicole C; Webster, Joan; Chan, Raymond J; Rickard, Claire M (1 de febrero de 2016). «Frequency of dressing changes for central venous access devices on catheter-related infections». En Cochrane Wounds Group, ed. Cochrane Database of Systematic Reviews (en inglés) 2: CD009213. PMID 26827714. doi:10.1002/14651858.CD009213.pub2.
- ↑ Lai, Nai Ming; Lai, Nai An; O'Riordan, Elizabeth; Chaiyakunapruk, Nathorn; Taylor, Jacqueline E; Tan, Kenneth (13 de julio de 2016). «Skin antisepsis for reducing central venous catheter-related infections». En Cochrane Wounds Group, ed. Cochrane Database of Systematic Reviews (en inglés) 2016 (7): CD010140. PMC 6457952. PMID 27410189. doi:10.1002/14651858.CD010140.pub2.
- ↑ «Management of occlusion and thrombosis associated with long-term indwelling central venous catheters». Lancet 374 (9684): 159-69. July 2009. PMC 2814365. PMID 19595350. doi:10.1016/S0140-6736(09)60220-8.
- ↑ «Genetics of venous thrombosis». Journal of Thrombosis and Haemostasis. 7 Suppl 1: 301-4. July 2009. PMID 19630821. doi:10.1111/j.1538-7836.2009.03394.x.
- ↑ «The risk factors and clinical outcomes of upper extremity deep vein thrombosis». Vascular and Endovascular Surgery 46 (2): 139-44. February 2012. PMID 22328450. doi:10.1177/1538574411432145.
- ↑ a b «Central venous catheter use. Part 1: mechanical complications». Intensive Care Medicine 28 (1): 1-17. January 2002. PMID 11818994. doi:10.1007/s00134-001-1154-9.
- ↑ «Anticoagulation for people with cancer and central venous catheters». The Cochrane Database of Systematic Reviews 6: CD006468. June 2018. PMC 6389340. PMID 29856471. doi:10.1002/14651858.CD006468.pub6.
- ↑ «Aberrant locations and complications in initial placement of subclavian vein catheters». Archives of Surgery 119 (3): 293-5. March 1984. PMID 6696623. doi:10.1001/archsurg.1984.01390150035009.
- ↑ a b «Diagnosis and treatment of vascular air embolism». Anesthesiology 106 (1): 164-77. January 2007. PMID 17197859. doi:10.1097/00000542-200701000-00026.
- ↑ «Future directions for ultrasound-guided central venous access». European Journal of Anaesthesiology 28 (5): 327-8. May 2011. PMID 21487264. doi:10.1097/EJA.0b013e328343b148.
- ↑ «Reducing major procedural complications from central venous catheterisation». Anaesthesia 66 (1): 6-9. January 2011. PMID 21198502. doi:10.1111/j.1365-2044.2010.06583.x.
- ↑ «Ultrasound-Guided Subclavian Vein Catheterization: A Systematic Review and Meta-Analysis». Critical Care Medicine 43 (7): 1498-507. July 2015. PMID 25803646. doi:10.1097/CCM.0000000000000973.
- ↑ «Subclavian oblique-axis catheterization technique». Critical Care 21 (1): 323. December 2017. PMC 5745903. PMID 29282100. doi:10.1186/s13054-017-1915-7.
- ↑ «Why Using Ultrasound for Vascular Access ? - EDM Medical Solutions».
- ↑ «Role of chest X-ray in citing central venous catheter tip: A few case reports with a brief review of the literature». Journal of Anaesthesiology Clinical Pharmacology 29 (3): 397-400. July 2013. PMC 3788245. PMID 24106371. doi:10.4103/0970-9185.117114.
- ↑ Ostadfar, Ali (1 de enero de 2016), «Chapter 1 – Fluid Mechanics and Biofluids Principles», en Ostadfar, Ali, ed., Biofluid Mechanics (en inglés) (Academic Press): 1-60, ISBN 978-0-12-802408-9, doi:10.1016/B978-0-12-802408-9.00001-6, consultado el 18 de marzo de 2020.
- ↑ Central Venous Catheters – Topic Overview from WebMD
- ↑ a b c d Glynda Rees Doyle and Jodie Anita McCutcheon. «8.2 Intravenous Fluid Therapy». Clinical Procedures for Safer Patient Care.
- ↑ «Preventing complications of central venous catheterization». The New England Journal of Medicine 348 (12): 1123-33. March 2003. PMID 12646670. doi:10.1056/NEJMra011883.
- ↑ «Heparin versus 0.9% sodium chloride locking for prevention of occlusion in central venous catheters in adults». The Cochrane Database of Systematic Reviews 7: CD008462. July 2018. PMC 6513298. PMID 30058070. doi:10.1002/14651858.CD008462.pub3.
- ↑ «Central venous catheter care for the patient with cancer: American Society of Clinical Oncology clinical practice guideline». Journal of Clinical Oncology 31 (10): 1357-70. April 2013. PMID 23460705. doi:10.1200/JCO.2012.45.5733.