Cloruro de fosforilo (comúnmente llamado oxicloruro de fósforo) es un líquido incoloro de fórmula POCl3. Se hidroliza en aire húmedo en ácido fosfórico para liberar vapores asfixiantes de cloruro de hidrógeno. Se fabrica industrialmente a gran escala a partir de tricloruro de fósforo y oxígeno o pentóxido de fósforo. Se utiliza principalmente para crear los ésteres de fosfato tales como fosfato de tricresilo.
Estructura
Como fosfato, el cloruro de fosforilo tiene forma tetraédrica. Cuenta con tres enlace P-Cl y un muy fuerte enlace doble P = O, con un estimado una energía de disociación de enlace de 533,5 kJ / mol. Sobre la base de longitud de enlace y electronegatividad, la regla Schomaker-Stevenson sugiere que la forma doble enlace es muy dominante (en contraste con POF3). El enlace P = O no se parece al enlace π en un grupo carbonilo como en una cetona. La descripción adecuada de la interacción PO es una cuestión de larga discusión. Los libros de texto más antiguos a favor de una descripción que llama a la participación de los orbitales d del fósforo. Algunos de estos proyectos orbitales d hacia el átomo de O, la superposición con los orbitales p del oxígeno. Los textos más modernos parecen estar a favor de una descripción del enlace P-O π involucra a componentes σ * del enlace Cl-P. Estas descripciones no tienen en cuenta el papel de los orbitales d.
- donde pm = picometros
Propiedades
Propiedades físicas
El POCl3 funde a 1,25 °C y a temperatura ambiente es líquido claro e incoloro, altamente tóxico, hidrólisis y fuertemente fumante al aire, refractivo. Hierve a 105,1 °C. El oxicloruro de fósforo líquido a 25 °C tiene una densidad de 1,645 g/cm³. En el estado gaseoso, la densidad relativa es 5,3 (aire = 1). Su presión de vapor a 20 °C es 37 hPa t a 50 °C, 139 hPa. La conductividad específica del líquido es de 2,10-8ohm-1·cm-1 debido a la baja disociación del oxicloruro en POCl2+ , y POCl 4-. En la práctica, contribuye a la conductividad, incluso en POCl3 extremadamente purificado el siempre presente contenido de humedad residual de 0,0001 mol / l, en el que la formación de H3 O+ Cl- .
El oxicloruro de fósforo líquido es un muy buena disolvente no acuosos para los cloruros de metales - formar soluciones altamente conductores - con la excepción de los cloruros alcalinos. Usando la medida de la conductividad por lo tanto puede ser muy cómodo para detectadar impurezas.
Se observa la formación de complejos con metales de transición.
Propiedades químicas
El POCl3 reacciona con el agua y alcoholes para dar cloruro de hidrógeno y ácido fosfórico o ésteres de fosfato, respectivamente:
- O=PCl3 + 3H2O → O=P(OH)3 + 3HCl
Si el agua se sustituye por un alcohol, el fosfato de trialquilo resultado ésteres. Tales reacciones se realizan a menudo en presencia de un aceptor de HCl tal como piridina o una amina. Si el POCl3 se calienta con un exceso de un fenol ( Ar OH) en la presencia de un ácido de Lewis catalizador tal como el cloruro de magnesio, un éster de fosfato de triarilo, se forma tales como fosfato de trifenilo. Por ejemplo:
- 3C 6 H 5 OH + O=PCl3 → S=P(OC6H5)3 + 3HCl
El POCl3 también puede actuar como una base de Lewis, formando aductos con una variedad de ácidos de Lewis tales como el tetracloruro de titanio:
- Cl3P+-O- + TiCl4 → Cl3P+O--TiCl4
El cloruro de aluminio aducto (POCl3 · AlCl3 ) es bastante estable, y así el POCl3 se puede utilizar para eliminar AlCl3 completamente a partir de mezclas de reacción al final de una reacción de Friedel-Crafts. El POCl3 reacciona con bromuro de hidrógeno en presencia de AlCl3 para producir POBr3.
Compatibilidad con los materiales
El oxicloruro de fósforo es debido a su contenido de cloro muy corrosivo y materia maduración largo. Entre los aceros inoxidables son austeníticos al cromo-níquel de acero o de grados de acero inoxidable 18-8 y 17-12-3 de oxicloruro de fósforo atacado sólo moderadamente rápido. El dichos materiales son por lo tanto conveniente para la construcción de tanques de almacenamiento y tanques que sirven para un almacenamiento temporal o su transporte. Poseen una mayor resistencia: el plomo, el níquel y el monel. Debido al riesgo de corrosión en la construcción de tuberías y preferentemente en la construcción de los reactores y tanques de almacenamiento a largo plazo de oxicloruro de fósforo es preferible vidrio glasarmierter o acero inoxidable y, posiblemente, plástico revestido de acero inoxidable , se utilizan. El uso exclusivo de los plásticos es debido a la permeabilidad a la humedad y a los gases prácticamente problemático en todos los plásticos y el riesgo de contaminación de producto por parte de las sustancias presentes. Entre los polímeros estables a temperaturas de hasta aproximadamente 30 °C, los siguientes tipos de límite plástico son compatibles con oxicloruro de fósforo:
- Polietileno de alta densidad (HDPE)
- Polipropileno (PP)
- Polifluoruro de vinilideno (PVDF)
- Etileno-tetrafluoroetileno copolímero (ETFE)
A temperaturas más altas se recomienda solo utilizar ETFE.
Con flúor recubiertos de plástico recipientes es de señalar que el recubrimiento de polímero en polvo sinterizado o fundida, no necesariamente libre de poros, y puede contener un aglutinante.
En general, hay que tener en cuenta que los plásticos no son de composición uniforme con los productos técnicos. Incluso plásticos con el mismo nombre corto a menudo difieren considerablemente en sus propiedades . Además, algunas de las siglas usado como nombre comercial y la etiqueta del grupo entero de productos. En este sentido, por ejemplo, a menudo son utilizado nombres tales como teflón y PTFE. En ausencia de datos fiables sobre la seguridad de los materiales debe renunciar al uso de un material en particular o dar un uso específico de pre-chequeo. Sacar conclusiones a partir del comportamiento del material en condiciones que subjetivamente aparecen similares es extremadamente peligrosa para la seguridad.
Síntesis
De laboratorio
El cloruro de fosforilo se pueden preparar por la reacción de tricloruro de fósforo con oxígeno a 20-50 °C (en aire resulta ineficaz):
La acción de cloruro de hidrógeno con óxido de fósforo:
La acción de cloruro de fósforo con óxido de fósforo:
Una síntesis alternativa implica la reacción de pentacloruro de fósforo ( PCl5) y pentóxido de fósforo ( P4O10). Dado que estos compuestos son sólidos, una manera conveniente de realizar la reacción es clorar una mezcla de PCl3 y P4O10, que genera el PCl5 in situ. A medida que el PCl3 se consume, el POCl3 se convierte en el disolvente de reacción.
El pentacloruro de fósforo también forma POCl3 por reacción con agua, pero esta reacción es menos fácil de controlar que la reacción anterior.
La descomposición de pentacloruro de fósforo :
Industrial
La producción industrial de oxicloruro de fósforo se realiza mediante diferentes métodos. Dado que se trata de importante materia prima de la síntesis inorgánica se que utiliza en muchos procesos de síntesis sensibles a los costos, los costes de producción juegan un papel decisivo en el proceso de selección. La atención se centra en procesos que proporcionan un producto final de calidad y a la vez generen pocos residuos. Son preferibles los métodos que permiten el uso de materias primas más baratas y los subproductos se puedan utilizar en otros procesos síntesis.
Un ejemplo de esta estrategia es la producción de oxicloruro de fósforo a partir de dióxido de azufre (SO2), obtenido en muchos procesos como un gas residual, cloro gaseoso (Cl2) y tricloruro de fósforo (PCl3):
Los resultados óptimos se obtienen con un control continuo de proceso continuo realizado en un tanque agitado o reactor de bucle o reactor de circuito.[1]
Se puede obtener con gases de desecho ricos en fosfina, como en la producción hipofosfito de sodio:
En el método produce inicialmente tricloruro de fósforo (PCl3), que al reaccionar con el oxígeno se oxida al producto final.[2]
En la preparación de ciertos compuestos heterocíclicos, incluyendo intermedios importantes para pesticidas, el fósforo es un subproducto. Separando el oxicloruro se pueden reducir significativamente los costes de producción de estos compuestos heterocíclicos.[3][4]
La oxidación directa del tricloruro de fósforo (PCl3) con oxígeno (O2) en fase líquida proporciona un oxicloruro de fósforo particularmente puro. Este método se usa especialmente cuando se busca la producción de fósforo, otro producto químico esencial en la industria química.
Para este método existe también una versión continua.[5]
En la industria química fina, la oxidación de fósforo generalmente se lleva a cabo de forma discontinua en un reactor de tanque agitado. Las desventajas de este litigio, pero el rendimiento variante volumen desfavorable de la reacción y la separación relativa del complejo oxicloruro de material de partida. Desde la especificación del producto, a menudo es el esfuerzo, que se hizo funcionar a la separación final y ver la calidad de la planta de producción.
Hay un método que lleva los problemas anteriormente descritos en cuenta.[6] En lugar de tricloruro de fósforo se utiliza el fósforo blanco como material de partida para la reacción. El fósforo se oxida primero con oxígeno y luego el fósforo con cloro elemental clorada. La reacción se lleva a cabo en fase líquida. Como medio de reacción y disolvente se empela - otra característica interesante de este proceso - el oxicloruro de fósforo sin purificar.
El oxicloruro de fósforo también se puede generar por combustión directa de fósforo en una llama de oxígeno-cloro.[7] Pero sin embargo, el proceso proporciona una mezcla muy compleja de productos y es técnicamente muy difícil de manejar.
Un desarrollo adicional del método descrito por AG Griesheim[8] se encuentra en la patente japonesa de 1994 de la Nippon Soda Corporation.[9] El proceso japonés se caracteriza por un mejor control del proceso, lo que permite un control preciso de la cloración.
En la literatura de patentes se describen muchos otros métodos que ahora ya no se utiliza. El lector interesado puede consultar la base de datos de patentes de libre acceso de la Oficina Europea de Patentes.[10]
Usos
El uso más importante para el cloruro de fosforilo se encuentra en la fabricación de ésteres triarylphosphate (como se ha descrito anteriormente ), tales como fosfato de trifenilo y fosfato de tricresilo . Estos ésteres se han utilizado durante muchos años como retardantes de llama y plastificantes para PVC. Mientras tanto ésteres trialquilo tales como fosfato de tributilo (hecho de manera similar a partir de butanol-1-ol ) se utilizan como extracción líquido-líquido en disolventes reprocesamiento nuclear y en otros lugares. En la industria de los semiconductores, POCl3 se utiliza como una fuente de líquido fósforo seguro en los procesos de difusión. El fósforo actúa como un dopante utilizado para crear tipo N capas sobre una oblea de silicio.
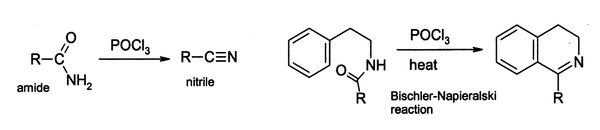
En el laboratorio, el POCl3 se utiliza ampliamente como agente deshidratante, por ejemplo en la conversión de amidas a nitrilos . Del mismo modo, ciertas amidas arilo puede ser ciclado a la derivados dihidro isoquinolina mediante la reacción de Bischler-Napieralski.
Tales reacciones se cree que suceden a través del cloruro de imidoilo; en ciertos casos en los que es estable, el cloruro de imidoilo es el producto final. Por ejemplo piridonas y pirimidonas se puede convertir en cloro-derivados de piridinas y pirimidinas, que son intermedios importantes en la industria farmacéutica.
Producción mundial y productores
El oxicloruro de fósforo es uno de los productos químicos inorgánicos básicos esenciales en la industria química. La producción anual de todo el mundo se estima actualmente (2010) en 200.000 toneladas. La producción se centra en Europa, EE. UU. y Japón además de también en China, India y Australia. Las instalaciones típicas tienen una capacidad anual de producción que van desde 5.000 a 10.000 toneladas.
Gran parte del oxicloruro de fósforo se procesa inmediatamente para dar productos secundarios. El Phosphoroxychloridproduktion tanto, se asocian a menudo con la producción de importantes productos secundarios, tales como la fabricación de aditivos para plásticos, retardantes de llama, pesticidas, lubricantes y fluidos funcionales llamados interconectados.
Las principales empresa productoras son: Supresta (EE. UU. y D), Lanxess (D), ICL, Israel Chemicals (IL), Thermophos (D), Albright & Wilson (AUS), BASF (D), Arkema (F), Nippon Soda (J), Jiangsu Changyu Chemical Co (CN) y Sandhya Grupo (IND).
Pureza y forma de entrega
El oxicloruro de fósforo, que se produce de acuerdo con una de la transformación de síntesis descrito anteriormente, es inicialmente fuertemente como más o menos de producto crudo contaminado. El perfil de impurezas del producto crudo está condicionado por el método de fabricación, el perfil de impurezas de los materiales de partida y, por lo menos no el estado de la planta destinada. Los sistemas modernos de producción consistentemente entregar una calidad ya muy alta y la pureza del producto bruto. La purificación adicional del producto bruto se realiza por destilación fraccionada, que puede por una fase sólida absorbente se añade. En la destilación, la reacción líquido y subproductos gaseosos y Rohmaterialienrestanteile - por ejemplo, tricloruro de fósforo (PCl 3 separadas -). El esfuerzo, el cual es operado en el tema Rohproduktaufreinigung, por supuesto, un estricto control de costes.
Otros factores que afectan a la pureza del producto son cruciales, el uso del producto después de la purificación, el producto envasado, el almacenamiento del producto en la fabricación y el transporte y almacenamiento y manipulación de la oxicloruro entre minoristas y consumidores.
Gran parte del fósforo producidos industrialmente oxicloruro se utiliza inmediatamente después de la preparación en los procesos posteriores. En el fósforo comercial viene con una especificación de pureza del 98 al 99,9999%. El caso del fósforo, las modernas plantas de producción a gran escala, son típicos valores de pureza de productos básicos > 99,9%. Como tricloruro de impurezas de fósforo más importante (PCL es 3 ) llamado. Es importante para algunas aplicaciones, el nivel de contaminación de metales es generalmente muy baja producción de fósforo fresco oxicloruro, ya que los metales de transición que ya están en las concentraciones traza de POCl3 inhiben el proceso de producción y por lo tanto se evita cuidadosamente desde el principio. Mencionado en la pureza total de la especificación del producto, como es habitual en los productos químicos, principalmente de la cantidad total de los activos incluidos en el análisis de contaminación del producto. Seguir desempeñando en la creación de las especificaciones técnicas las consideraciones de marketing juegan un papel importante. Es habitual, por ejemplo, ofrecer productos de alta pureza mercados de destino diferentes, según las especificaciones de cada cliente.
Seguridad
Con la humedad del aire o el agua el oxicloruro de fósforo reacciona de inmediato y de forma fuertemente exotérmica. La reacción de hidrólisis conduce a la formación de muy corrosivo, fósforo que contiene ácido clorhídrico y humos, que también pueden contener fósforo en forma de vapor. Algo de protección contra las quemaduras y envenenamiento químico resultantes en fuga o derrame de Phosphoroxychloridmengen pequeña del hecho de que el fósforo debido a su baja presión de vapor, se evapora lentamente, los vapores son más pesados que el aire y se vaporiza fósforo hidrolizada en aire húmedo muy rápidamente. Si derrames o fugas en espacios cerrados, sin embargo, el abandono inmediato de la zona es inevitable.
La producción industrial está controlada bajo la Convención sobre Armas Químicas, donde aparece enumerada en la tabla 3 (son los productos químicos que se pueden utilizar como armas químicas tóxicas por sí mismos o utilizarlos en la fabricación de armas químicas pero que también tienen grandes aplicaciones industriales legítimas).
Véase también
Referencias
- ↑ US-Patent US5498400, Great Lakes Chemical Corp.
- ↑ US-Patent US6685904, Occicdental Chemical Corp.
- ↑ Patent EP0900762, DSM Fine Chemicals Austria GmbH.
- ↑ DE19730224, Bayer AG.
- ↑ US-Patent US4183905, Mobil Oil Corp.
- ↑ DE1194382, Griesheim Knappsack AG.
- ↑ DE 801513, BASF AG.
- ↑ DE1194382, Knappsack Griesheim AG.
- ↑ JP6122509, Nippon Soda Corp.
- ↑ Europäisches Patentamt
Lecturas recomendadas
- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- J. March, Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.
- The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960.
- A. D. F. Toy, The Chemistry of Phosphorus, Pergamon Press, Oxford, UK, 1973.
- L. G. Wade, Jr., Organic Chemistry, 6th ed., p. 477, Pearson/Prentice Hall, Upper Saddle River, New Jersey, USA, 2005.
- B. J. Walker, Organophosphorus chemistry, p101-116, Penguin, Harmondsworth, UK, 1972.