| Dalteparina sódica | ||
|---|---|---|
 Jeringuilla precargada de dalteparina para inyección subcutánea | ||
 | ||
| Identificadores | ||
| Número CAS | 9041-08-1 | |
| Código ATC | B01AB04 | |
| DrugBank | DB06779 | |
| Datos químicos | ||
| Fórmula | C26H40N2O36S5 | |
| Peso mol. | 6000 g/mol | |
| Farmacocinética | ||
| Biodisponibilidad | 81-93% | |
| Vida media | 3-5 horas | |
| Datos clínicos | ||
| Nombre comercial | Fragmin | |
| Vías de adm. |
Inyección subcutánea (Excepto para hemodiálisis) | |
La dalterparina sódica es un medicamento anticoagulante que pertenece a una clase de fármacos conocidos como heparinas de bajo peso molecular (HBPM). Se utiliza en la prevención y el tratamiento de enfermedades tromboembólicas. También se utiliza para reducir el riesgo de infarto de miocardio en el caso de embolia pulmonar.[1] Actúa potenciando el efecto de la antitrombina, la cual inhibe la formación de trombina y factor Xa.[2] Generalmente se administra mediante inyección subcutánea.
Características
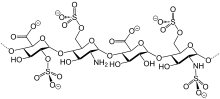
La dalteparina es una sal sódica formada por una mezcla de polisacáridos procedentes de la heparina. Se obtiene por despolimerización con ácido nitroso de la heparina sin fraccionar. Tiene una estructura de 2-O-Sulfo-α-L-ácido dopironasurónico en el extremo de la cadena no reductora y una estructura de 2,5 anhidro-6-O-sulfo-D-manitol en el extremo de la cadena reductora. Su peso molecular medio es de 6000 Daltons. La relación media ente anti-factor Xa y antitrombina (anti IIa) es de 2,5.[3]
Usos Médicos
Indicaciones
La nadroparina está indicada en la profilaxis de las enfermedades tromboembólicas, en particular tras una cirugía ortopédica y en determinados tipos de cirugía general.[4][5] Este fármaco se prescribe también para el tratamiento de pacientes con trombosis venosa profunda.[6] y para la prevención de la coagulación en casos de hemodiálisis extracorpórea.[7]
Vía de administración y dosis
La dalteparina se administra como una solución de sal sódica en suero fisiológico, aplicada en forma de inyección subcutánea, generalmente en la zona del abdomen. La dosis se expresa en términos de unidades de actividad antifactor Xa. La dosis más común es de 2500 UI.
Debido al riesgo de Trombocitopenia inducida por heparina (HIT), el número de plaquetas debe controlarse regularmente durante el tratamiento. Ocasionalmente, puede producirse trombocitopenia leve y temporal (tipo I) al comienzo del tratamiento con dalteparina, lo cual no produce generalmente complicaciones. En caso de trombocitopenia grave (tipo II), el tratamiento con nadroparina debe interrumpirse inmediatamente y tampoco se podrán utilizar otras heparinas para inhibir la coagulación de la sangre.[1]
Contraindicaciones
La dalteparina, al igual que otras heparinas de bajo peso molecular, no debe usarse en caso de hipersensibilidad al principio activo. Tampoco debe administrarse en pacientes con trastornos de coagulación, como la un recuento bajo de plaquetas (trombocitopenia o en caso de tendencia o riesgo de hemorragia.[1]
Farmacología
Mecanismo de acción
Las heparinas de bajo peso molecular difieren en su efecto de la heparina estándar principalmente en el hecho de que inhiben predominantemente el factor Xa en la cascada de coagulación. Además, su vida media plasmática es más larga que el de la heparina sin fraccionar. En el caso de la dalteparina, esta es de aproximadamente 4 horas tras su administración.[8]
Farmacocinética
Los parámetros farmacocinéticos de la dalteparina sódica se miden en función de la actividad inhibidora del factor Xa de la coagulación. Tras la inyección por vía subcutánea, el fármaco alcanza el pico de concentración plasmática aproximadamente a las 3 horas. Su vida media plasmática es de aproximadamente 4 horas y su actividad de inhibición del Factor Xa se mantiene durante al menos 24 horas tras su administración.[9] Su biodisponibilidad es de aproximadamente el 90%.[10] La dalteparina se elimina principalmente por vía renal.[11]
Véase también
- Heparina de bajo peso molecular
- Trombosis venosa profunda
- Factor de coagulación
- Heparina
- Anticoagulante
Referencias
- ↑ a b c Agencia Española del Medicamento (ed.). «Prospecto Dalteparina Sódica 12.500 UI Fragmin».
- ↑ Pfizer Medical Information. «Fragmin Pharmacodynamics». Archivado desde el original el 7 de mayo de 2021. Consultado el 5 de enero de 2023.
- ↑ European Pharmacopoeia Commission, ed. (2016). European Pharmacopoeia 9.0. p. 2194.
- ↑ Kakkar VV (1984). «Prevention of post-operative venous thromboembolism by a new low molecular weight heparin fraction». Nouv Rev Fr Hematol 26 (4): 277-282. PMID 6473097.
- ↑ Kakkar VV, Murray WJ (Octubre de 1985). «Efficacy and safety of low-molecular-weight heparin (CY216) in preventing postoperative venous thrombo-embolism: a co-operative study». Br J Surg 72 (10): 786-791. PMID 3899240.
- ↑ Hull RD, Raskob GE, Pineo GF, et al. (Abril de 1992). «Subcutaneous low-molecular-weight heparin compared with continuous intravenous heparin in the treatment of proximal-vein thrombosis». N. Engl. J. Med. 326 (15): 975-982. PMID 1545850. doi:10.1056/NEJM199204093261502.
- ↑ Kamper AM, Lins RL, Zachée P, Van Bergen S, Hosten S, Daelemans R (1997). «Safety of combining ticlopidine with nadroparin in the routine treatment of chronic hemodialysis patients». Nephron 77 (4): 484-485. PMID 9434075.
- ↑ Collignon F, Frydman A, Caplain H, et al. (Abril de 1995). «Comparison of the pharmacokinetic profiles of three low molecular mass heparins--dalteparin, enoxaparin and nadroparin--administered subcutaneously in healthy volunteers (doses for prevention of thromboembolism)». Thromb. Haemost. 73 (4): 630-640. PMID 7495071.
- ↑ Frydman A. Low-molecular-weight heparins: an overview of their pharmacodynamics, pharmacokinetic.
- ↑ Harenberg J, Würzner B, Zimmermann R, Schettler G (noviembre de 1986). «Bioavailability and antagonization of the low molecular weight heparin CY 216 in man». Thromb. Res. 44 (4): 549–54. PMID 3798415.
- ↑ Douketis J, Cook D, Meade M, “”et al.“” (septiembre de 2008). Prophylaxis against deep vein thrombosis in critically ill patients with severe Intern. Med. 168 (16). pp. 1805-1812. PMID 18779469. doi:10.1001/archinte.168.16.1805.








