La descarboxilación es una reacción química en la cual un grupo carboxilo es eliminado de un compuesto en forma de dióxido de carbono (CO2).[1]
En química orgánica
El interés sintético de esta reacción es suprimir el grupo carboxilo (–COOH) del producto tras haber sido útil o no en un intermedio de la síntesis. Esto puede ser más o menos fácil, calentando más o menos para lograrlo, en función del grupo R unido al carboxilo.
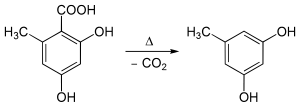
Por ejemplo, la descarboxilación del ácido orselínico se produce por un calentamiento a unos 176 °C:
Descarboxilación de β-cetoácidos
En el caso de β-cetoácidos se consigue relativamente fácil la descarboxilación de estos compuestos gracias a que se forma un estado de transición cíclico.
En el siguiente ejemplo, puede verse la descarboxilación del ácido acetoacético (o ácido 3-oxobutanoico) espontánea, generándose acetona:
Un ejemplo de esto se puede encontrar en la síntesis malónica, en la condensación de Knoevenagel, etc.
En química organometálica

Las reacciones de descarboxilación de carboxilatos metálicos (R-CO2M), se producen fácilmente mediante calefacción de los compuestos, en estado sólido, en disolución, o incluso en suspensión acuosa; y son una vía de síntesis para algunos compuestos organometálicos.[2]
Un ejemplo de este tipo de reacción podría ser el siguiente:
Estos compuestos organomercuriales R2Hg se obtienen por pirólisis de los carboxilatos de mercurio. Para que esta reacción se produzca en buenas condiciones, suele ser conveniente que el grupo R sea un grupo electroatractor (R= C6F5, CF3, CCl3...)
Existen variaciones a este tipo de descarboxilación de compuestos organometálicos. Una de éstas sería la reacción de Hunsdiecker en la que se usa plata como metal, generándose un carboxilato de plata como intermedio en la reacción de síntesis correspondiente.
En bioquímica
La descarboxilación es una reacción metabólica fundamental durante la oxidación de moléculas orgánicas, catalizada por enzimas del tipo descarboxilasa. La descarboxilación del piruvato es una reacción clave de la respiración aeróbica en la cual una molécula de piruvato pierde su grupo carboxilo en forma de CO2 y rinde acetil CoA, que ingresa en el ciclo de Krebs, en donde se producen descarboxilaciones adicionales.
El acetoacetato (un cuerpo cetónico) sufre una descarboxilación espontánea, no enzimática, a acetona.
Descarboxilación de aminoácidos
Los aminoácidos sufren descarboxilación a aminas; un ejemplo particular sería la descarboxilación de la histidina a histamina.Un aminoácido tiene un grupo carboxilo (en rojo en la imagen) que puede ser descarboxilado. Existe una enzima descarboxilasa para cada aminoácido. En las bacterias, la descarboxilación es la responsable de la putrefacción, así transforman la lisina (C6H14N2O2) en cadaverina (C5H14N2), la ornitina (C5H12N2O2) en putrescina (C4H12N2), etc.
Las descarboxilaciones oxidativas biosintéticas más comunes de aminoácidos a aminas son:
- Triptófano a triptamina
- Fenilalanina a feniletilamina
- Tirosina a tiramina
- Histidina a histamina
- Serina a etanolamina
- Ácido glutámico a GABA
- Lisina a cadaverina
- Arginina a agmatina
- Ornitina a putrescina
- L-DOPA a dopamina
- 5-Hidroxitriptófano (5-HTP) a serotonina.
Otras reacciones de descarboxilación incluyen al ciclo del ácido cítrico:
- Piruvato a acetil-CoA (ver oxidación del piruvato)
- Oxalosuccinato a α-cetoglutarato
- α-cetoglutarato a Succinil-CoA.
Otras descarboxilaciones de interés
En varios ciclos metabólicos se pueden encontrar reacciones de descarboxilación. Por ejemplo, en el ciclo de Krebs, se producen una serie de reacciones de descarboxilación:
- Piruvato a acetil-CoA.
- Isocitrato (que previamente a la descarboxilación se transforma en oxalosuccinato) a α-cetoglutarato.
- α-cetoglutarato a succinil-coA.
Un metabolito que se obtiene en otras vías metabólicas (como en la β-oxidación), es el malonil-CoA, que por acción de la malonil-CoA descarboxilasa se produce acetil-CoA y CO2 como subproducto (al tratarse de una reacción de descarboxilación).
Véase también
- Carboxilación
- Descarboxilasa
- Descarboxilación oxidativa
- Electrólisis de Kolbe
- Descarboxilación de Krapcho
- Reacción de Hunsdiecker
- Descarboxilación de Barton
Bibliografía
- K. Peter C. Vollhardt (1994). Química Orgánica. Barcelona: Ediciones Omega S.A. ISBN 84-282-0882-4.
- Devlin, T. M. 2004. Bioquímica, 4.ª edición. Reverté, Barcelona. ISBN 84-291-7208-4
- David L. Nelson y Michael M. Cox, "Lehninger. Principios de bioquímica" Editorial Omega. Quinta edición. ISBN 978-84-282-1486-5
Referencias
- ↑ Hofmann, A. W. v. Berichte der Deutschen Chemischen Gesellschaft 1881, 14, 2725
- ↑ Glen B. Deacon, Suellen J. Faulks*, Geoffrey N. Pain; F.G.A. Stone and Robert West (1986). «The Synthesis of Organometallics by Decarboxylation Reactions». Advances in Organometallic Chemistry 25: 237-276. doi:10.1016/S0065-3055(08)60576-6.