
El gas (palabra inventada por el científico flamenco Jan Baptista van Helmont en el siglo XVII, sobre el latín chaos[1]) es un estado de agregación de la materia en el cual, bajo ciertas condiciones de temperatura y presión, sus moléculas interaccionan o reaccionan débilmente entre sí, sin formar enlaces moleculares,[2] adoptando la forma y el volumen del recipiente que las contiene y tendiendo a separarse, esto es, expandirse, todo lo posible por su alta concentración de energía cinética. Los gases son fluidos altamente compresibles, que experimentan grandes cambios de densidad con la presión y la temperatura.[3]
Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas entre sí, lo que explica sus propiedades:[4]
- Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias[5] y de atracción entre las moléculas son despreciables, en comparación con la velocidad a la que se mueven sus moléculas.
- Los gases ocupan completamente el volumen del recipiente que los contienen.
- Los gases no tienen forma definida, adoptando la de los recipientes que los contienen.
- Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
A temperatura y presión ambientales los gases pueden ser elementos como el hidrógeno, el oxígeno, el nitrógeno, el cloro, el flúor y los gases nobles, compuestos como el dióxido de carbono o el propano, o mezclas como el aire.
Los vapores y el plasma comparten propiedades con los gases y pueden formar mezclas homogéneas, por ejemplo vapor de agua y aire; en conjunto son conocidos como cuerpos gaseosos, estado gaseoso[6] o fase gaseosa.
Historia
En 1648 el químico Jan Baptista van Helmont, considerado el padre de la química neumática, creó el vocablo "gas" (durante un tiempo se usó también "estado aeriforme"), a partir del término griego kaos (desorden) para definir las características del anhídrido carbónico. Esta denominación se extendió luego a todos los cuerpos gaseosos, también llamados fluidos elásticos, fluidos compresibles o aires, y se utiliza para designar uno de los estados de la materia.
La principal característica de los gases respecto de los sólidos y los líquidos, es que no pueden verse ni tocarse, pero también se encuentran compuestos de átomos y moléculas.
La causa de la naturaleza del gas se encuentra en sus moléculas, muy separadas unas de otras y con movimientos aleatorios entre sí. Al igual que ocurre con los otros dos estados de la materia, el gas también puede transformarse (en líquido) si se somete a temperaturas muy bajas. A este proceso se le denomina condensación en el caso de los vapores y licuefacción en el caso de los gases perfectos.
La mayoría de los gases necesitan temperaturas muy bajas para lograr condensarse. Por ejemplo, en el caso del oxígeno, la temperatura necesaria es de –183 °C.[7]
Las primeras leyes de los gases fueron desarrollados desde finales del siglo XVII, cuando los científicos empezaron a darse cuenta de que en las relaciones entre la presión, el volumen y la temperatura de una muestra de gas, en un sistema cerrado, se podría obtener una fórmula que sería válida para todos los gases. Estos se comportan de forma similar en una amplia variedad de condiciones, debido a la buena aproximación que tienen las moléculas que se encuentran más separadas, y hoy en día la ecuación de estado para un gas ideal se deriva de la teoría cinética. Ahora las leyes anteriores de los gases se consideran como casos especiales de la ecuación del gas ideal, con una o más de las variables mantenidas constantes
Empíricamente, se observan una serie de relaciones proporcionales entre la temperatura, la presión y el volumen que dan lugar a la ley de los gases ideales, deducida por primera vez por Émile Clapeyron en 1835
Comportamiento macroscópico de los gases
Al observar un gas, es típico especificar un marco de referencia o una escala de longitud. Una escala de longitud mayor corresponde a un punto de vista macroscópico o global del gas. Esta región (denominada volumen) debe tener un tamaño suficiente para contener una gran muestra de partículas de gas. El análisis estadístico resultante de este tamaño de muestra produce el comportamiento "promedio" (es decir, velocidad, temperatura o presión) de todas las partículas de gas dentro de la región. Por el contrario, una escala de longitud más pequeña corresponde a un punto de vista microscópico o de partículas.
Macroscópicamente, las características del gas medidas son en términos de las propias partículas del gas (velocidad, presión o temperatura) o de su entorno (volumen). Por ejemplo, Robert Boyle estudió química neumática durante una pequeña parte de su carrera. Uno de sus experimentos relacionó las propiedades macroscópicas de la presión y el volumen de un gas. Su experimento utilizó un manómetro de tubo en J que parece un tubo de ensayo con la forma de la letra J. Boyle atrapó un gas inerte en el extremo cerrado del tubo de ensayo con una columna de mercurio, lo que hace que el número de partículas y la temperatura sean constantes. Observó que cuando se aumentaba la presión en el gas, al agregar más mercurio a la columna, el volumen del gas atrapado disminuía (esto se conoce como relación inversa). Además, cuando Boyle multiplicó la presión y el volumen de cada observación, el producto fue constante. Esta relación se mantuvo para cada gas que Boyle observó que condujo a la ley (PV = k), nombrada en honor a su trabajo en este campo.
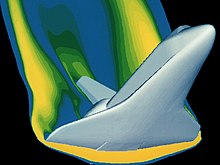
Hay muchas herramientas matemáticas disponibles para analizar las propiedades de los gases. A medida que los gases están sujetos a condiciones extremas, estas herramientas se vuelven más complejas, desde las ecuaciones de Euler para el flujo no viscoso hasta las ecuaciones de Navier-Stokes[8] que explican completamente los efectos viscosos. Estas ecuaciones se adaptan a las condiciones del sistema de gas en cuestión. El equipo de laboratorio de Boyle permitió el uso de álgebra para obtener sus resultados analíticos. Sus resultados fueron posibles porque estaba estudiando gases en situaciones de presión relativamente baja donde se comportaban de una manera "ideal". Estas relaciones ideales se aplican a los cálculos de seguridad para una variedad de condiciones de vuelo en los materiales en uso. El equipo de alta tecnología que se utiliza hoy en día fue diseñado para ayudarnos a explorar con seguridad los entornos operativos más exóticos donde los gases ya no se comportan de una manera "ideal". Esta matemática avanzada, que incluye estadísticas y cálculo multivariable, posibilita la solución a situaciones dinámicas tan complejas como la reentrada de vehículos espaciales. Un ejemplo es el análisis de la reentrada del transbordador espacial que se muestra en la imagen para garantizar que las propiedades del material bajo esta condición de carga sean adecuadas. En este régimen de vuelo, el gas ya no se comporta de manera ideal.
Leyes de los gases
Existen diversas leyes derivadas de modelos simplificados de la realidad que relacionan la presión, el volumen y la temperatura de un gas.
Ley de Boyle-Mariotte
La Ley de Boyle-Mariotte (o Ley de Boyle), formulada por Robert Boyle y Edme Mariotte, es una de las leyes de los gases que relaciona el volumen y la presión de una cierta cantidad de gas mantenida a temperatura constante. La ley dice que a una temperatura constante y para una masa dada de un gas, el volumen del gas varía de manera inversamente proporcional a la presión absoluta del recipiente:
Matemáticamente se puede expresar así:
donde es constante si la temperatura y la masa del gas permanecen constantes.[9]
Cuando aumenta la presión el volumen baja, mientras que si la presión disminuye el volumen aumenta. No es necesario conocer el valor exacto de la constante para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
donde:
Además, si se despeja cualquier incógnita se obtiene lo siguiente:
Ley de Charles
A una presión dada, el volumen ocupado por una cierta cantidad de un gas es directamente proporcional a su temperatura en kelvin.[10]
Matemáticamente la expresión sería:
- o .
en términos generales:
Ley de Gay-Lussac
La presión de una cierta cantidad de gas, que se mantiene a volumen constante, es directamente proporcional a la temperatura en kelvin:[10]
Es por esto que para poder envasar gas, como gas licuado, primero ha de enfriarse el volumen de gas deseado, hasta una temperatura característica de cada gas, a fin de poder someterlo a la presión requerida para licuarlo sin que se sobrecaliente y finalmente, explote.
Ley general de los gases
Combinando las tres leyes anteriores se obtiene:
Ley de los gases ideales
De la ley general de los gases se obtiene la ley de los gases ideales.[10] Su expresión matemática es:
siendo la presión, el volumen, el número de moles, la constante universal de los gases ideales y la temperatura en kelvin. Tomando el volumen de un mol a una atmósfera de presión y a 273 K, como 22,4 L se obtiene el valor de R = 0,082 atm·L·K−1·mol−1
El valor de R depende de las unidades que se estén utilizando:
- R = 0,082 atm·L·K−1·mol−1 si se trabaja con atmósferas y litros
- R = 8,31451 J·K−1·mol−1 si se trabaja en Sistema Internacional de Unidades
- R = 1,987 cal·K−1·mol−1
- R = 8,31451 × 10−10 erg ·K−1·mol−1
- R = 8,31451 × 10−3 m3·kPa/(mol·K) si se trabaja con metros cúbicos y kilo pascales
De esta ley se deduce que un mol (6,022 x 1023 átomos o moléculas) de gas ideal ocupa siempre un volumen igual a 22,4 litros a 0 °C y 1 atmósfera. Véase también Volumen molar. También se le llama la ecuación de estado de los gases, ya que solo depende del estado actual en que se encuentre el gas.
Gases reales
Si se quiere afinar más, o si se quiere medir el comportamiento de algún gas que escapa al comportamiento ideal, habrá que recurrir a las ecuaciones de los gases reales, que son variadas y más complicadas cuanto más precisas.
Los gases reales no se expanden infinitamente, sino que llegaría un momento en el que no ocuparían más volumen. Esto se debe a que entre sus partículas, ya sean átomos como en los gases nobles o moléculas como en el (O2) y la mayoría de los gases, se establecen unas fuerzas bastante pequeñas, debido a los cambios aleatorios de sus cargas electrostáticas, a las que se llama fuerzas de Van der Waals.
El comportamiento de un gas suele concordar más con el comportamiento ideal cuanto más sencilla sea su fórmula química y cuanto menor sea su reactividad ( tendencia a formar enlaces). Así, por ejemplo, los gases nobles al ser moléculas monoatómicas y tener muy baja reactividad, sobre todo el helio, tendrán un comportamiento bastante cercano al ideal. Les seguirán los gases diatómicos, en particular el más liviano hidrógeno. Menos ideales serán los triatómicos, como el dióxido de carbono; el caso del vapor de agua aún es peor, ya que la molécula al ser polar tiende a establecer puentes de hidrógeno, lo que aún reduce más la idealidad. Dentro de los gases orgánicos, el que tendrá un comportamiento más ideal será el metano, perdiendo idealidad a medida que se engrosa la cadena de carbono. Así, el butano es de esperar que tenga un comportamiento ya bastante alejado de la idealidad. Esto es, porque cuanto más grande es la partícula constituyente del gas, mayor es la probabilidad de colisión e interacción entre ellas, factor que hace disminuir la idealidad. Algunos de estos gases se pueden aproximar bastante bien mediante las ecuaciones ideales, mientras que en otros casos hará falta recurrir a ecuaciones reales muchas veces deducidas empíricamente a partir del ajuste de parámetros.
También se pierde la idealidad en condiciones extremas, como altas presiones o bajas temperaturas. Por otra parte, la concordancia con la idealidad puede aumentar si trabajamos a bajas presiones o altas temperaturas. También por su estabilidad química.
Comportamiento a escala microscópica
Si fuera posible observar un gas a través de un microscopio suficientemente potente como para ver las partículas que lo forman (moléculas, átomos, iones), las veríamos moviéndose de una manera más o menos aleatoria. Estas partículas que forman el gas solo cambian la dirección de su movimiento cuando colisionan con otra partícula o contra las paredes del contenedor. Si consideramos que estas colisiones son perfectamente elásticas , podremos considerar la sustancia como un gas ideal. El comportamiento de las partículas a nivel microscópico es descrito por la teoría cinética de los gases.
Teoría cinética de los gases
La teoría cinética proporciona información sobre las propiedades macroscópicas de los gases al considerar su composición molecular y su movimiento. Comenzando con las definiciones de momento y energía cinética [16] se puede usar la conservación del momento y las relaciones geométricas de un cubo para relacionar las propiedades macroscópicas del sistema de temperatura y presión con la propiedad microscópica de la energía cinética por molécula. La teoría proporciona valores promediados para estas dos propiedades.
La teoría cinética de los gases puede ayudar a explicar cómo el sistema (considerando la colección de partículas de gas) responde a los cambios de temperatura, con el correspondiente cambio de energía cinética.
Por ejemplo: imagine que tiene un recipiente sellado de tamaño fijo (volumen constante), que contiene un número fijo de partículas de gas; partiendo del cero absoluto (la temperatura teórica a la que los átomos o moléculas no tienen energía térmica, es decir, no se mueven ni vibran), se empieza a añadir energía al sistema calentando el recipiente, de modo que la energía se transfiera a las partículas del interior. Una vez que su energía interna está por encima de la energía de punto cero, es decir, su energía cinética (también conocida como energía térmica) es distinto de cero, las partículas de gas comenzarán a moverse alrededor del contenedor. A medida que la caja se calienta más (a medida que se agrega más energía), las partículas individuales aumentan su velocidad promedio a medida que aumenta la energía interna total del sistema. La mayor velocidad promedio de todas las partículas conduce a una mayor velocidad a la que ocurren las colisiones (es decir, mayor número de colisiones por unidad de tiempo), entre las partículas y el contenedor, así como entre las partículas mismas.
A nivel macroscópico la cantidad medible de la presión, es el resultado directo de estas micro colisiones de partículas escópicos con la superficie, sobre la que, moléculas individuales ejercen una pequeña fuerza, cada uno contribuyendo a la fuerza total aplicada dentro de un área específica.
Asimismo, la cantidad de temperatura medible macroscópicamente es una cuantificación de la cantidad total de movimiento o energía cinética que exhiben las partículas.
Movimiento browniano

El movimiento browniano es el modelo matemático utilizado para describir el movimiento aleatorio de partículas suspendidas en un fluido. La animación de las partículas de gas, usando partículas rosadas y verdes, ilustra cómo este comportamiento da como resultado la propagación de los gases (entropía). Estos eventos también se describen mediante la teoría de partículas.
Dado que está en el límite (o más allá) de la tecnología actual para observar partículas de gas individuales (átomos o moléculas), solo los cálculos teóricos dan sugerencias sobre cómo se mueven, pero su movimiento es diferente del movimiento browniano porque el movimiento browniano implica un arrastre suave debido a la fuerza de fricción de muchas moléculas de gas, puntuada por violentas colisiones de una (o varias) molécula (s) de gas con la partícula. La partícula (que generalmente consta de millones o miles de millones de átomos) se mueve así en un curso irregular, pero no tan irregular como se esperaría si se examinara una molécula de gas individual.
Fuerzas intermoleculares
Al comprimir un gas, las fuerzas intermoleculares, como los enlaces de hidrógeno entre las moléculas de agua de la imagen, comienzan a tener un papel más activo.
Las atracciones o repulsiones momentáneas entre las partículas tienen un efecto sobre la dinámica del gas. En química física, el nombre que reciben las fuerzas intermoleculares es el de fuerzas de Van der Waals. Estas fuerzas tienen un papel en la determinación de las propiedades físicas de un gas, como por ejemplo su viscosidad o su flujo volumétrico. Si ignoramos estas fuerzas en determinadas condiciones podremos tratar un gas real como si fuera un gas ideal, esta asunción nos permitirá utilizar la ley de los gases ideales. La correcta utilización de estas relaciones a los gases requiere volver a la teoría cinética. Cuando las partículas del gas poseen una carga magnética o fuerza intermolecular su influencia sobre las otras moléculas se incrementa a medida que se reduce el espacio que hay entre ellas. En ausencia de cargas, a un punto determinado donde el espacio entre las partículas se ha reducido lo suficiente ya no se pueden evitar las colisiones entre las partículas a una temperatura normal.
Otra vía para incrementar el número de colisiones entre las partículas de una gas sería calentar un determinado volumen fijo de gas, además temperatura más velocidad de las partículas y más probabilidad de que haya colisiones. Todo esto significa que estas ecuaciones ideales proporcionan unos resultados razonables excepto para casos con una gran presión o temperatura (ionización). Estas condiciones excepcionales permiten la transferencia de energía en el interior del gas, y es precisamente la ausencia de transferencias internas de energía lo que permite hablar de condiciones ideales, a las que el intercambio de energía solo se produce en los límites del sistema.
Los gases reales experimentan algunas de estas colisiones y fuerzas intermoleculares, pero mientras sean estadísticamente despreciables los resultados de las ecuaciones ideales seguirán siendo válidos. Por otro lado, cuando las partículas de un gas son comprimidas por lo que son muy cercanas las unas de las otras, el gas se comporta de manera más parecida a un líquido, es la ausencia de transferencias internas de energía lo que nos permite hablar de condiciones ideales, a las que el intercambio de energía solo se produce en los límites del sistema. Los gases reales experimentan algunas de estas colisiones y fuerzas intermoleculares, pero mientras sean estadísticamente despreciables los resultados de las ecuaciones ideales seguirán siendo válidos.
Comportamiento de los gases
Para el comportamiento térmico de partículas de la materia existen cuatro cantidades medibles que son de gran interés: presión, volumen, temperatura y masa de la muestra del material (o mejor aún cantidad de sustancia, medida en moles).
Cualquier gas se considera un fluido porque tiene las propiedades que le permiten comportarse como tal.
Sus moléculas, en continuo movimiento, colisionan elásticamente entre sí y contra las paredes del recipiente que contiene al gas, contra las que ejercen una presión permanente. Si el gas se calienta, esta energía calorífica se invierte en energía cinética de las moléculas, es decir, las moléculas se mueven con mayor velocidad, por lo que el número de choques contra las paredes del recipiente aumenta en número y energía. Como consecuencia la presión del gas aumenta, y si las paredes del recipiente no son rígidas, el volumen del gas aumenta.
Un gas tiende a ser activo químicamente debido a que su superficie molecular es también grande, es decir, al estar sus partículas en continuo movimiento chocando unas con otras, esto hace más fácil el contacto entre una sustancia y otra, aumentando la velocidad de reacción en comparación con los líquidos o los sólidos.
Para entender mejor el comportamiento de un gas, siempre se realizan estudios con respecto al gas ideal, aunque este en realidad nunca existe y las propiedades de este son:
- Una sustancia gaseosa pura está constituida por moléculas de igual tamaño y masa. Una mezcla de sustancias gaseosas está formada por moléculas diferentes en tamaño y masa.
- Debido a la gran distancia entre unas moléculas y otras y a que se mueven a gran velocidad, las fuerzas de atracción entre las moléculas se consideran despreciables.
- El tamaño de las moléculas del gas es muy pequeño, por lo que el volumen que ocupan las moléculas es despreciable en comparación con el volumen total del recipiente. La densidad de un gas es muy baja.
- Las moléculas de un gas se encuentran en constante movimiento a gran velocidad, por lo que chocan elásticamente de forma continua entre sí y contra las paredes del recipiente que las contiene.
Para explicar el comportamiento de los gases, las nuevas teorías utilizan tanto la estadística como la teoría cuántica, además de experimentar con gases de diferentes propiedades o propiedades límite, como el UF6, que es el gas más pesado conocido.
Un gas no tiene forma ni volumen fijo; se caracteriza por la casi nula cohesión y la gran energía cinética de sus moléculas, las cuales se mueven.
Cambios de densidad
El efecto de la temperatura y la presión en los sólidos y líquidos es muy pequeño, por lo que típicamente la compresibilidad de un líquido o sólido es de 10−6 bar−1 (1 bar=0,1 MPa) y el coeficiente de dilatación térmica es de 10−5 K−1.
Por otro lado, la densidad de los gases es fuertemente afectada por la presión y la temperatura. La ley de los gases ideales describe matemáticamente la relación entre estas tres magnitudes:
donde es la constante universal de los gases ideales, es la presión del gas, su masa molar y la temperatura absoluta.
Eso significa que un gas ideal a 300 K (27 °C) y 1 atm duplicará su densidad si se aumenta la presión a 2 atm manteniendo la temperatura constante o, alternativamente, se reduce su temperatura a 150 K manteniendo la presión constante.
Presión de un gas
En el marco de la teoría cinética, la presión de un gas es explicada como el resultado macroscópico de las fuerzas implicadas por las colisiones de las moléculas del gas con las paredes del contenedor. La presión puede definirse por lo tanto haciendo referencia a las propiedades microscópicas del gas.
En efecto, para un gas ideal con N moléculas, cada una de masa m y moviéndose con una velocidad aleatoria promedio vrms contenido en un volumen cúbico V, las partículas del gas impactan con las paredes del recipiente de una manera que puede calcularse de manera estadística intercambiando momento lineal con las paredes en cada choque y efectuando una fuerza neta por unidad de área, que es la presión ejercida por el gas sobre la superficie sólida.
La presión puede calcularse como:
(gas ideal)
Este resultado es interesante y significativo no solo por ofrecer una forma de calcular la presión de un gas sino porque relaciona una variable macroscópica observable, la presión, con la energía cinética promedio por molécula, 1/2 mvrms², que es una magnitud microscópica no observable directamente. Nótese que el producto de la presión por el volumen del recipiente es dos tercios de la energía cinética total de las moléculas de gas contenidas.
Tópicos especiales
Compresibilidad

En termodinámica se utiliza este factor ("Z") para alterar la ecuación del gas ideal para tener en cuenta los efectos de compresibilidad de los gases reales. Este factor representa la relación entre los volúmenes específicos reales y los ideales. A veces se lo denomina "factor de modificación" o corrección para ampliar el rango útil de la ley de los gases ideales para fines de diseño. Normalmente este valor de Z está muy cerca de la unidad. La imagen del factor de compresibilidad ilustra cómo Z varía en un rango de temperaturas muy frías.
Número de Reynolds
En mecánica de fluidos, el número de Reynolds es la relación entre las fuerzas de inercia (vsρ) y las fuerzas viscosas (μ/L). Es uno de los números adimensionales más importantes en la dinámica de fluidos y se usa, generalmente junto con otros números adimensionales, para proporcionar un criterio para determinar la similitud dinámica. Como tal, el número de Reynolds proporciona el vínculo entre los resultados del modelado (diseño) y las condiciones reales a gran escala. También se puede utilizar para caracterizar el flujo.[11]
Viscosidad
La viscosidad, una propiedad física, es una medida de qué tan bien se adhieren las moléculas adyacentes entre sí. Un sólido puede soportar una fuerza de cizallamiento debido a la fuerza de estas fuerzas intermoleculares pegajosas. Un fluido se deformará continuamente cuando se somete a una carga similar. Si bien un gas tiene un valor de viscosidad más bajo que un líquido, sigue siendo una propiedad observable. Si los gases no tuvieran viscosidad, entonces no se adherirían a la superficie de un ala delta y formarían una capa límite. Un estudio del ala delta en la imagen de Schlieren revela que las partículas de gas se adhieren entre sí.[11]
Turbulencia

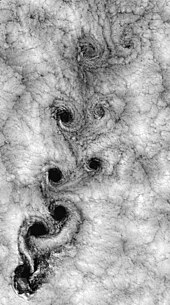
En la dinámica de fluidos, la turbulencia o el flujo turbulento es un régimen de flujo caracterizado por cambios caóticos y estocásticos en las propiedades. Esto incluye difusión de momento bajo, convección de momento alto y variación rápida de presión y velocidad en el espacio y el tiempo. La vista satelital del clima alrededor de las islas Juan Fernández ilustra un ejemplo.[11]
Capa límite
Las partículas se "pegan" a la superficie de un objeto que se mueva a través de él. Esta capa de partículas se llama capa límite. En la superficie del objeto, es esencialmente estático debido a la fricción de la superficie. El objeto, con su capa límite, es efectivamente la nueva forma del objeto que el resto de las moléculas "ven" a medida que el objeto se acerca. Esta capa límite puede separarse de la superficie, esencialmente creando una nueva superficie y cambiando por completo la trayectoria del flujo. El ejemplo clásico de esto es un perfil alar que entra en pérdida. La imagen del ala delta muestra claramente el engrosamiento de la capa límite a medida que el gas fluye de derecha a izquierda a lo largo del borde de ataque.[11]
Principio de máxima entropía
A medida que el número total de grados de libertad se acerca al infinito, el sistema se encontrará en el macroestado que corresponde a la mayor multiplicidad. Para ilustrar este principio, observe la temperatura de la superficie de una barra de metal congelada. Usando una imagen térmica de la temperatura de la superficie, observe la distribución de temperatura en la superficie. Esta observación inicial de temperatura representa un "microestado". En algún momento futuro, una segunda observación de la temperatura de la superficie produce un segundo microestado. Al continuar este proceso de observación, es posible producir una serie de microestados que ilustran la historia térmica de la superficie de la barra. La caracterización de esta serie histórica de microestados es posible eligiendo el macroestado que los clasifica con éxito a todos en una sola agrupación.
Equilibrio termodinámico
Cuando cesa la transferencia de energía de un sistema, esta condición se conoce como equilibrio termodinámico. Por lo general, esta condición implica que el sistema y los alrededores están a la misma temperatura, por lo que el calor ya no se transfiere entre ellos. También implica que las fuerzas externas están equilibradas (el volumen no cambia) y que todas las reacciones químicas dentro del sistema están completas. El cronograma varía para estos eventos según el sistema en cuestión. Un bloque de hielo, a una temperatura media, tarda horas en derretirse, mientras que en los semiconductores la transferencia de calor que ocurre en la transición del dispositivo de un estado encendido a apagado podría ser del orden de unos pocos nanosegundos.
Véase también
Referencias
- ↑ «gas.» Diccionario de la lengua española. Avance de la vigésima tercera edición. Consultado el 15 de septiembre de 2015.
- ↑ Villarreal Marín, Nicole. «Enlaces moleculares». Consultado el 24 de mayo de 2017.
- ↑ Alejandrina, GALLEGO PICÓ; María, GARCINUÑO MARTÍNEZ Rosa; José, MORCILLO ORTEGA Mª; Ángel, VÁZQUEZ SEGURA Miguel (4 de diciembre de 2013). QUÍMICA BÁSICA. Editorial UNED. ISBN 9788436267846. Consultado el 16 de febrero de 2017.
- ↑ Alejandrina, GALLEGO PICÓ; María, GARCINUÑO MARTÍNEZ Rosa; José, MORCILLO ORTEGA Mª; Ángel, VÁZQUEZ SEGURA Miguel (4 de diciembre de 2013). QUÍMICA BÁSICA. Editorial UNED. ISBN 9788436267846. Consultado el 9 de febrero de 2018.
- ↑ Fisica Lab. «Fuerza gravitatoria». Consultado el 24 de mayo de 2017.
- ↑ www.ecured.cu. «Estado gaseoso». Consultado el 24 de mayo de 2017.
- ↑ Física: principios con aplicaciones. Pearson Educación. 1 de enero de 2006. ISBN 9789702606956. Consultado el 16 de febrero de 2017.
- ↑ Anderson, p.501
- ↑ Ercilla, Santiago Burbano de; Muñoz, Carlos Gracia (1 de enero de 2003). Física general. Editorial Tebar. ISBN 9788495447821. Consultado el 16 de febrero de 2017.
- ↑ a b c John, James (1984). Gas Dynamics. Allyn and Bacon. ISBN 978-0-205-08014-4.
- ↑ a b c d John, James (1984). Gas Dynamics. Allyn and Bacon. ISBN 978-0-205-08014-4.
Bibliografía
- Anderson, John D. (1984). Fundamentals of Aerodynamics. McGraw-Hill Higher Education. ISBN 978-0-07-001656-9.
- John, James (1984). Gas Dynamics. Allyn and Bacon. ISBN 978-0-205-08014-4.
- McPherson, William; Henderson, William (1917). An Elementary study of chemistry.
- Philip Hill and Carl Peterson. Mechanics and Thermodynamics of Propulsion: Second Edition Addison-Wesley, 1992. ISBN 0-201-14659-2
- National Aeronautics and Space Administration (NASA). Animated Gas Lab.
- Georgia State University. HyperPhysics.
- Antony Lewis WordWeb.
- Northwestern Michigan College The Gaseous State.
 Varios autores (1910-1911). «Encyclopædia Britannica». En Chisholm, Hugh, ed. Encyclopædia Britannica. A Dictionary of Arts, Sciences, Literature, and General information (en inglés) (11.ª edición). Encyclopædia Britannica, Inc.; actualmente en dominio público.
Varios autores (1910-1911). «Encyclopædia Britannica». En Chisholm, Hugh, ed. Encyclopædia Britannica. A Dictionary of Arts, Sciences, Literature, and General information (en inglés) (11.ª edición). Encyclopædia Britannica, Inc.; actualmente en dominio público.
Enlaces externos
 Wikimedia Commons alberga una categoría multimedia sobre Gases.
Wikimedia Commons alberga una categoría multimedia sobre Gases. Wikiquote alberga frases célebres de o sobre Gas.
Wikiquote alberga frases célebres de o sobre Gas. Wikcionario tiene definiciones y otra información sobre gas.
Wikcionario tiene definiciones y otra información sobre gas.
- El Diccionario de la Real Academia Española tiene una definición para gas.

































