
Morfogénesis (del griego morphê: forma + génesis creación, “origen de la forma”) es el proceso biológico que lleva a que un organismo desarrolle su forma. Es una de las tres ramas de estudio centrales de la Biología del Desarrollo, junto al Crecimiento celular y la Diferenciación celular.
El proceso controla la distribución espacial organizada de células durante el desarrollo embrionario de un organismo. La morfogénesis también tiene lugar en un organismo maduro, en los cultivo de células o dentro de las masas tumorales. La morfogénesis también describe el desarrollo de formas de vida unicelular que no atraviesan por una etapa embrionaria en sus ciclos de vida, o describe la evolución de una estructura corporal dentro de un grupo taxonómico. Esta perspectiva evolutiva es abordada desde la Biología Evolutiva del Desarrollo (Evo-Devo).
Las respuestas morfogenética pueden ser inducidas por sustancias químicas –llamadas morfógenos–, contaminantes ambientales o por deformaciones espaciales.
Historia
[editar]Los primeros estudios sobre morfogénesis fueron realizados en por D’arcy Wentworth Thompson (On growth and form, 1927)[1] quienes buscaban describir de manera matemática los patrones naturales, como las espirales de la filotaxis, o las formas animales dada por las conchas de caracoles.

En 1930 Joachim Hammerling determinó que los núcleos son requeridos para morfogénesis. En los primeros estudios morfogenéticos que realizó, usó diferentes especies de algas del género Acetabularia. Hammerling utilizó dos especies distintas de Acetabularia, la A. mediterranea y la A. crenulata. Este organismo consta de tres partes: Sombrerillo, Tallo y Rizoide, donde el único núcleo de esta célula se localiza en el rizoide.
El experimento consistió en que Hammerling intercambió los núcleos de las dos especies, y con esto logró que se formara el sombrerillo característico del donante del núcleo. Así se vio que el núcleo desempeñaba un papel en el control del desarrollo de la Acetabularia.
Alan Turing en su libro The Chemical Basis of Morphogenesis (1952),[2] logró predecir el mecanismo básico de la morfogénesis, al expresar que debían existir dos señales químicas diferentes, una que active el crecimiento y otra que lo limite. Si bien Turing nunca logró ver estos patrones en la vida real, su explicación se aproximó demasiado a lo que años más tardes describirían los biólogos.[3]
El estudio llevado a cabo por estos investigadores, disparó otro trabajo de investigación que culminó con el descubrimiento de la estructura del ADN en 1953. A partir de datos de difracción de rayos X recogidos por Rosalind Franklin, James D. Watson y Francis Crick. Con esto nació la biología molecular y la bioquímica.
En 1960 Lewis Wolpert refinó el concepto de morfógeno de Turing, proponiendo el modelo de bandera francesa para explicar la acción de los morfógenos sobre los tejidos en desarrollo. Estas ideas se reafirmaron con el trabajo de Christiane Nusslein-Volhard, que descubrió el primer morfógeno: Bicoid, en la mosca Drosophila melanogaster.
Actualmente, la morfogénesis se aplica para analizar la formación total de un organismo, ya sea la estructura de cada célula que lo compone, la capacidad de las células de los organismos para crear tejidos (diferenciación celular) y el ordenamiento del cuerpo de cada ser vivo (segmentación).
Mecanismos moleculares
[editar]Véase también: Diferenciación celular & Regulación de la Expresión Génica.
Diversos tipos de moléculas son particularmente importantes durante la morfogénesis. Entre estos destacan los morfógenos, moléculas solubles que señalizan y controlan la diferenciación celular mediante gradientes de concentración. Otro grupo de moléculas importantes son los factores de transcripción, que ayudan a determinar el destino celular al interactuar con el ADN, mediante complejas redes regulatorias. Finalmente, hay moléculas que controlar procesos de migración y adhesión celular.
Por ejemplo, durante la gastrulación, grupos de células madre suprimen sus uniones intercelulares, se vuelven migratorias y toman nuevas posiciones dentro del embrión, donde vuelven a activar proteínas de adhesión específicas y forman nuevos tejidos y órganos.[4]
Mecanismos Celulares
[editar]A nivel tisular, la morfogénesis se expresa como una proliferación y motilidad celular, cambiando la estructura celular y las interacciones celulares.[5] Estos cambios se pueden ver reflejados en elongación del tejido, adelgazamiento, plegamiento, invasión, separación de un tejido en diferentes capas (cell sorting).[6]
Adhesión célula-célula
[editar]
Durante el desarrollo embrionario, las células están restringidas a diferentes capas debido a afinidades diferenciales. Una de las formas en que esto puede ocurrir, es cuando las células comparten las mismas moléculas de adhesión intercelular.
Existen diferentes tipos de moléculas de adhesión celular (CAM). Uno de los grupos más importantes son las cadherinas, existen diversas cadherinas expresadas a lo largo de diferentes tejidos. Estas moléculas pueden unirse entre sí de manera homotípica, por ejemplo, las E-cadherinas (epiteliales) se unen a otras E-cadherinas, y no se unirán a N-cadherinas presentes en células mesenquimales.
Las adhesiones homotipicas puede mantener los límites entre los grupos célulares de un tejido en desarrollo. Además, las células se pueden ordenar en capas según las diferencias en moléculas de adhesiones intercelular, por lo que dos poblaciones de células con distintos niveles de la misma molécula de adhesión pueden ordenarse. Por ejemplo, en un cultivo celular las células que tengan la mayor adhesión se mueven hacia el centro de una mezcla de células agregadas, mientras que las células meno adheridas se distribuirán en zonas periféricas.
Experimento de Townes y Holtfreter
[editar]
La relación de las adhesiones celulares y la morfogénesis fue establecida por Johannes Townes y Philip L. Holtfreter en 1955.[7] Aprovechando el descubrimiento de que los tejidos de anfibio llegan a disociarse en células individuales cuando son colocados en soluciones alcalinas, prepararon suspensiones celulares individuales de cada una de las tres capas germinales de los embriones de anfibio poco después de la neurulación. Dos o más de estas suspensiones de células individuales fueron combinadas en varios sentidos. Cuando el pH de la solución estaba normalizado, las células se adherían entre sí, formando agregados sobre las placas de Petri cubiertas de agar.
Utilizando embriones de rana y salamandras, Townes y Holtfreter pudieron seguir el comportamiento de las células recombinadas. Los resultados de sus experimentos fueron sorprendentes. Primero, encontraron que las células reagregadas llegaban a estar espacialmente segregadas. Es decir, los dos tipos celulares en lugar de continuar mezclados, se separaban cada uno de ellos en su propia región. De este modo, cuando las células ectodérmicas y las células mesodérmicas son reunidas para formar un agregado mezclado, las células ectodérmicas se mueven hacia el interior. En ningún caso las células recombinadas se mantienen mezcladas y en la mayoría de los casos, un tipo de tejido envuelve completamente a otro.
Segundo, los investigadores encontraron que las posiciones finales de los reagregados celulares reflejan sus posiciones embrionarias. Las células mesodérmicas migran centralmente con respecto a la epidermis, adhiriéndose a la superficie epidérmica interna. En la configuración final, el ectodermo está en la periferia, el endodermo es interno y el mesodermo se localiza en la región entre ellos. Holtfreter interpretó este hallazgo en términos de afinidad selectiva.
Hipótesis de adhesión diferencial
[editar]Malcolm Steinberg propuso en 1964 la hipótesis de la adhesión diferencial basada en principios termodinámicos. Consiste en diferencias en la afinidad celular y en como estas diferencias son responsables de su organización en estructuras superiores. Algunas células realizan lo que se conoce como “sorting out”, lo que quiere decir que las células interactúan y se agrupan creando grupos que maximizan su contacto. Reduciendo así su energía libre intersuperficial y la que segregan a otros tipos celulares. Esto quiere decir que se organizan en el patrón más estable termodinámicamente. Ahora sabemos que existen propiedades de adhesividad y otras repulsivas.
Matriz extracelular
[editar]La morfogénesis celular se lleva a cabo en un ambiente con biomoléculas, proteínas y fluidos, la matriz extracelular (ECM del inglés extracellular matrix). Dentro de los principales componentes encontramos el colágeno, la laminina y la fibronectina son las principales moléculas que son secretadas y ensambladas en láminas, fibras, y geles. Al actuar como soporte externo, la matriz permite a las células migrar o cambiar su forma según los programas de diferenciación ejecutados.

Las señales provistas por la matriz son recibidas por receptores transmembranales llamados integrinas. Las integrinas son capaces de reonocer la fibronectina o laminina extracelular. En los dominios citoplasmáticos de la proteína, encontramos sitios de unión con comoponentes de citoesqueleto como la actina. Estas uniones permiten a la células migrar sobre la matriz o cambiar su forma.[4]
Podemos encontrar ejemplos donde la alteración de la matriz extracelular altera el desarrollo normal de cierto órganos. En el caso de las glándulas mamarias, cuando se altera la matriz extracelular, la ramificación del tejido no se puede llevar a cabo correctamente.[8][9] Otro ejemplo la pérdida de fusión cardiaca en pez cebra, cuando se elimina la fibronectina.[10][11] Del mismo modo, se ha visto que la pérdida de fibronectina altera el desarrollo renal.[12]
Citoesqueleto
[editar]Los cambios en la forma llevados a cabo por el citoesqueleto se deben gracias a las estructuras que lo forman, los filamentos de actina, los microtúbulos y los filamentos intermedios. Los micrafilamentos de actina son unos filamentos finos y flexibles formados por la polimerización de monómeros de actina. Estos microfilamentos se pueden contraer y relajar por la acción de la miosina para mover el mantenimiento o cambio de la forma celular y generar fuerzas. El movimiento se realiza encima de la matriz extracelular. Cuando la miosina se une al ATP se puede desplazar y unirse a monómeros de actina juntando los filamentos y reduciendo la célula. Se fosforila y contrae los filamentos de actina.
Asimismo existen señales externas que pueden regular el citoesqueleto a través de una familia de proteínas llamadas Rho-Rho, Rac y Cdc42. La activación de las Rho GTPasas permite la activación de la polimerización de la actina así como la fosforilación de la cadena ligera de miosina. Rho facilita la contracción de la actomiosina. Señales como fuerzas, presión o cambios en la adhesividad pueden activar Rho, el cual se activa por intregrinas i otros receptores. De esta manera el citoesqueleto recibe señales continuamente. Por ejemplo, un anillo de actomiosina se genera rápidamente cuando se debe cerrar una herida.
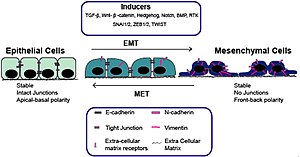
Transición epitelio-mesénquima
[editar]Uno de los fenómenos más importantes en el desarrollo es la transición epitelio-mesénquima. Este es el proceso mediante el cual las células de características epiteliales, altamente adheridas y en contacto con una lámina basal; se transforman en células mesénquimales, móviles y desagregadas.
Para que esto ocurra suele haber una disminución de las adhesiones mediadas por cadherinas, una reorganización del citoesqueleto y la degradación de la matriz extracelular (mediado por metalopreoteasas).[4]
Este proceso resulta fundamental en diferentes etapas del desarrollo, como la generación de la cresta neural, formación del mesodermo en aves o la formación de somitas. Incluso en procesos pos-embrionarios como la curación de heridas o el metástasis en cáncer.
Véase también
[editar]- Morfógeno
- Diferenciación celular
- Ontogenia
- Organogénesis
- Segmentación (biología)
- Embriogenesis
- Neurulación
- Gastrulación
- Embriogénesis en Drosophila
- Biología del desarrollo
Referencias
[editar]- ↑ Thompson, D'Arcy Wentworth (1917). On growth and form.. University press,. Consultado el 7 de mayo de 2020.
- ↑ «The chemical basis of morphogenesis». Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences (en inglés) 237 (641): 37-72. 14 de agosto de 1952. ISSN 2054-0280. doi:10.1098/rstb.1952.0012. Consultado el 7 de mayo de 2020.
- ↑ Hiscock, Tom W.; Megason, Sean G. (2015-12). «Orientation of Turing-like Patterns by Morphogen Gradients and Tissue Anisotropies». Cell Systems (en inglés) 1 (6): 408-416. PMC 4707970. PMID 26771020. doi:10.1016/j.cels.2015.12.001. Consultado el 7 de mayo de 2020.
- ↑ a b c Gilbert, Scott F., 1949-. Developmental biology (Eleventh edition edición). ISBN 978-1-60535-470-5. OCLC 945169933. Consultado el 7 de mayo de 2020.
- ↑ Montévil, Maël; Speroni, Lucia; Sonnenschein, Carlos; Soto, Ana M. (2016-10). «Modeling mammary organogenesis from biological first principles: Cells and their physical constraints». Progress in Biophysics and Molecular Biology (en inglés) 122 (1): 58-69. doi:10.1016/j.pbiomolbio.2016.08.004. Consultado el 8 de mayo de 2020.
- ↑ Davies, Jamie A. (2005). Mechanisms of morphogenesis. Elsevier Academic Press. ISBN 0-08-045443-7. OCLC 76937968. Consultado el 8 de mayo de 2020.
- ↑ Townes, Philip L.; Holtfreter, Johannes (1955-02). «Directed movements and selective adhesion of embryonic amphibian cells». Journal of Experimental Zoology 128 (1): 53-120. ISSN 0022-104X. doi:10.1002/jez.1401280105. Consultado el 8 de mayo de 2020.
- ↑ Fata JE, Werb Z, Bissell MJ (2004). «Regulation of mammary gland branching morphogenesis by the extracellular matrix and its remodeling enzymes». Breast Cancer Res. 6 (1): 1-11. PMC 314442. PMID 14680479. doi:10.1186/bcr634.
- ↑ Sternlicht MD (2006). «Key stages in mammary gland development: the cues that regulate ductal branching morphogenesis». Breast Cancer Res. 8 (1): 201. PMC 1413974. PMID 16524451. doi:10.1186/bcr1368. Archivado desde el original el 6 de octubre de 2014. Consultado el 4 de diciembre de 2010.
- ↑ Le A. Trinh; Stainier, Didier Y.R (2004-03). «Fibronectin Regulates Epithelial Organization during Myocardial Migration in Zebrafish». Developmental Cell (en inglés) 6 (3): 371-382. doi:10.1016/S1534-5807(04)00063-2. Consultado el 8 de mayo de 2020.
- ↑ Garavito-Aguilar, Z. V.; Riley, H. E.; Yelon, D. (1 de octubre de 2010). «Hand2 ensures an appropriate environment for cardiac fusion by limiting Fibronectin function». Development (en inglés) 137 (19): 3215-3220. ISSN 0950-1991. PMC 2934734. PMID 20724450. doi:10.1242/dev.052225. Consultado el 8 de mayo de 2020.
- ↑ Perens, Elliot A; Garavito-Aguilar, Zayra V; Guio-Vega, Gina P; Peña, Karen T; Schindler, Yocheved L; Yelon, Deborah (2 de noviembre de 2016). «Hand2 inhibits kidney specification while promoting vein formation within the posterior mesoderm». eLife (en inglés) 5: e19941. ISSN 2050-084X. PMC 5132343. PMID 27805568. doi:10.7554/eLife.19941. Consultado el 8 de mayo de 2020.
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre Morfogénesis.
Wikimedia Commons alberga una categoría multimedia sobre Morfogénesis.- Artificial Life model of multicellular morphogenesis with autonomously generated gradients for positional information








