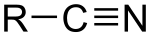
Los nitrilos son compuestos orgánicos que poseen un grupo de cianuro (-C≡N) como grupo funcional principal. Son derivados orgánicos del cianuro de los que el hidrógeno ha sido sustituido por un radical alquilo.
Nomenclatura
Los nitrilos, generalmente, se nombran utilizando el sufijo -nitrilo. En el caso de que el grupo funcional ciano no sea el principal del compuesto, se utilizan los prefijos ciano- o cianuro de...
| C | Nombre del compuesto | Estructura | PM (g/mol) | P.Fus. (°C) | P.Eb. (°C) |
|---|---|---|---|---|---|
| 1 | cianuro de hidrógeno | 27,0 | -13,24 | 25,7 | |
| 2 | acetonitrilo o etanonitrilo[1] | 41,0 | -45 | 81 | |
| 3 | propionitrilo o propanonitrilo[2] | 55,1 | -92 | 97 | |
| 4 | butironitrilo o butanonitrilo[3] | 69,1 | -112 | 116-118 | |
| 5 | pentanonitrilo[4] | 83,1 | -96 | 139 | |
| 6 | hexanonitrilo[5] | 97 | -80 | 161-164 | |
| 7 | heptanonitrilo o enantonitrilo[6] | 111,2 | -64 | 186-187 | |
| 8 | octanonitrilo o caprilonitrilo[7] | 125,2 | -45 | 198-200 | |
| 9 | nonanonitrilo o pelargononitrilo[8] | 139,2 | -35 | 224 | |
| 10 | decanonitrilo[9] | 153,3 | N/D | 241-243 |
Algunos nitrilos reciben nombres especiales:
- Acrilonitrilo CH2=CH-CN
- Malononitrilo NC-CH2-CN
- Piruvonitrilo CH3-CO-CN
- Cianógeno NC-CN
- Cloruro de cianógeno NC-Cl
Propiedades físicas
El grupo ciano está polarizado de tal forma que el átomo de carbono es el extremo positivo del dipolo y el nitrógeno el negativo. Esta polaridad hace que los nitrilos estén muy asociados en estado líquido. Así, sus puntos de ebullición son algo superiores a los de los alcoholes de masa molecular comparable. Los nitrilos de más de 15 carbonos son sólidos.[10] Exceptuando los primeros de la serie, son sustancias insolubles en agua. La mayoría de los nitrilos tienen un olor que recuerda al del cianuro de hidrógeno y son moderadamente tóxicos.
Síntesis
El primer compuesto de la serie homóloga de los nitrilos, el nitrilo del ácido fórmico, llamado ácido cianhídrico fue sintetizado primero por C. W. Scheele en 1782.[11][12] En 1811 J. L. Gay-Lussac pudo preparar el ácido puro.[13] Hacia 1832 el benzonitrilo, el nitrilo del ácido benzoico, fue preparado por Friedrich Wöhler y Justus von Liebig, pero debido al rendimiento mínimo de la síntesis, no se determinaron las propiedades físicas ni químicas ni se sugirió una estructura. En 1834 Théophile-Jules Pelouze sintetizó propionitrilo, y sugirió que era un éter de alcohol propiónico y ácido cianhídrico.[14]
El cianógeno puede ser preparado en el laboratorio mediante cianuro de mercurio. Industrialmente, se hace mediante la oxidación del cianuro de hidrógeno, usando normalmente cloro sobre un catalizador activo de dióxido de silicio o dióxido de nitrógeno sobre una sal de cobre. El cianógeno también se forma cuando el nitrógeno (N2) y acetileno (C2H2) se les hace reaccionar mediante una chispa eléctrica o una descarga.
2 CuSO4 + 4KCN → 2 Cu(CN)2 + 2 K2SO4 → NCCN + 2 CuCN + 2K2SO4
Mezclando soluciones de sales de cobre(II) (como el sulfato cúprico) con cianógenos, se forma un cianuro de cobre(II) inestable que se descompone rápidamente en cianuro de cobre(I) y cianógeno.[15]
El cloruro de cianógeno es una molécula con conectividad ClCN. Se produce por la oxidación del cianuro de sodio con dicloro.[16]
- NaCN + Cl2 → ClCN + NaCl
Los nitrilos se obtienen de manera general por acción del cianuro de sodio o de potasio sobre los haluros de alquilo, y también calentando las amidas en presencia de un deshidratante. Los nitrilos alifáticos pueden obtenerse mediante la sustitución nucleófila del átomo de halógeno de un halogenuro de alquilo por ataque del agente nucleófilo CN-, procedente de un cianuro alcalino, según la reacción esquemática:
R—X + CN-Na+
R—CN + X-Na+
Este método no puede utilizarse para la obtención de nitrilos aromáticos, puesto que los halogenuros de arilo son muy inertes a la sustitución nucleófila. Por ello, en lugar de estos se utilizan las sales de diazonio, en las que puede sustituirse fácilmente el grupo diazo por un agente nucleófilo, según la reacción esquemática:
N+NX- + CN-Na+
CN + N2 + X-Na+
| Nombre de la reacción | Sustrato | Detalles |
|---|---|---|
| Síntesis de nitrilos de Kolbe | Halogenuros de alquilo | Reactivo: Cianuro de sodio o de potasio.
|
| Amoxidación | Alquenos | Reactivo: Un alqueno se oxida parcialmente en presencia de amoniaco. Esta conversión se practica a gran escala para el acrilonitrilo:
|
| Reacción de Rosenmund–von Braun | Bromuros de arilo | Reactivo: Cianuro cuproso. Método para obtener derivados del benzonitrilo. |
| Reacción de Sandmeyer | Sales de diazonio | Reactivo: Cianuro cuproso. Método para obtener derivados del benzonitrilo.
 |
| Cianohidrinas | Cetonas o aldehídos | Reactivo: Adición del anión cianuro al carbono del carbonilo
 |
| Cianuro de acilo | Cetena | Reactivo: Se hace reaccionar una cetena con cianuro de hidrógeno a 350 °C
 |
| Por formación de aldoximas | Aldehído | Reactivo: Hidroxilamina y sulfato de sodio en zeolita
 |
| Deshidratación de amidas primarias | Amida primaria | Reactivo: Diclorofosfato de etilo y DBU
 |
| Degradación de amidas de von Braun | Amida sustituida | Reactivo: Pentacloruro de fósforo
 |
| Síntesis de nitrilos de Letts | Ácido carboxílico | Reactivo: Tiocianato de potasio
 |
Reacciones
Una de las reacciones más utilizadas de los nitrilos es su hidrólisis a ácidos carboxílicos. Esta reacción tiene lugar en presencia de un ácido o de una base fuertes, y en ambos casos el primer producto es una amida, que no puede ser aislada a menos que su velocidad de hidrólisis sea inferior a la del nitrilo inicial.
Referencias
- ↑ Acetonitrilo Archivado el 22 de agosto de 2009 en Wayback Machine.. Fichas Internacionales de Seguridad Química.
- ↑ Propionitrilo Archivado el 7 de enero de 2010 en Wayback Machine.. Fichas Internacionales de Seguridad Química.
- ↑ Butironitrilo Archivado el 7 de enero de 2010 en Wayback Machine.. Fichas Internacionales de Seguridad Química.
- ↑ Pentanenitrile. Chemical Book (en inglés)
- ↑ Hexanonitrilo. MSDS (en inglés).
- ↑ Heptanenitrile. (en inglés).
- ↑ Octanenitrile Archivado el 22 de febrero de 2017 en Wayback Machine.. Safety Data Sheet (en inglés).
- ↑ nonanenitrile. Safety Data Sheet (en inglés).
- ↑ Decanenitrile. Safety Data Sheet (en inglés).
- ↑ Yúfera, Eduardo Primo (1996). «Nitrilos. Nitrilos y ácidos carboxílicos insaturados.». Química orgánica básica y aplicada: de la molécula a la industria, Volumen 1. Reverté. ISBN 84-291-7953-4.
- ↑ See:
- Carl W. Scheele (1782) "Försök, beträffande det färgande ämnet uti Berlinerblå" (Experiment concerning the colored substance in Berlin blue), Kungliga Svenska Vetenskapsakademiens handlingar (Royal Swedish Academy of Science's Proceedings), 3: 264–275 (in Swedish).
- Reprinted in Latin as: "De materia tingente caerulei berolinensis" in: Carl Wilhelm Scheele with Ernst Benjamin Gottlieb Hebenstreit (ed.) and Gottfried Heinrich Schäfer (trans.), Opuscula Chemica et Physica (Leipzig ("Lipsiae"), (Germany): Johann Godfried Müller, 1789), vol. 2, pages 148–174.
- ↑ David T. Mowry (1948). «The Preparation of Nitriles» (– Scholar search). Chemical Reviews 42 (2): 189-283. PMID 18914000. doi:10.1021/cr60132a001. Uso incorrecto de la plantilla enlace roto (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ Gay-Lussac produced pure, liquified hydrogen cyanide in: Gay-Lussac (1811) "Note sur l'acide prussique" (Note on prussic acid), Annales de chimie, 44: 128 – 133.
- ↑ J. Pelouze (1834). «Notiz über einen neuen Cyanäther» [Note on a new cyano-ether]. Annalen der Pharmacie 10 (3): 249. doi:10.1002/jlac.18340100302.
- ↑ T. K. Brotherton, J. W. Lynn (1959). «The Synthesis And Chemistry Of Cyanogen». Chemical Reviews 59 (5): 841 - 883. doi:10.1021/cr50029a003.
- ↑ Coleman, G. H.; Leeper, R. W.; Schulze, C. C. (1946). «Cyanogen Chloride». Inorganic Syntheses 2: 90-94. doi:10.1002/9780470132333.ch25.










