Los péptidos[1] (del griego antiguo: πεπτός [peptós] ‘digerido’) son un tipo de molécula formadas por la unión de varios aminoácidos mediante enlaces peptídicos (enlaces amida).[2]
Los péptidos, al igual que las proteínas, están presentes en la naturaleza y son responsables de un gran número de funciones, muchas de las cuales todavía no se conocen.
La unión de un bajo número de aminoácidos da lugar a un péptido, y si el número es alto, a una proteína, aunque los límites entre ambos no están definidos.[3][4][5]
Características
Los péptidos con menos de 10-20 aminoácidos también pueden denominarse oligopéptidos; aquellos con más aminoácidos, polipéptidos.
- Oligopéptido: de 2 a 10 aminoácidos.
- Dipéptidos si el número de aminoácidos es 2. Tripéptidos si el n.º de aminoácidos es 3. Tetrapéptidos si el n.º de aminoácidos es 4.[6]
- Péptido: entre 10 y 50 aa.[6]
- Polipéptido: entre 51 y 100 aa.[7][8]
Las proteínas fabricadas en el interior de las células se forman con uno o más polipéptidos.[7]
Para otros, 100 aminoácidos es el límite entre un péptido y una proteína.[8][9][10][11]
Los autores difieren mucho en cuanto a dónde comienzan a usar el término proteína.[12]
Los péptidos se diferencian de las proteínas en que son más pequeños (tienen por convención menos de 10.000 o 12.000 Daltons de masa) y que las proteínas pueden estar formadas por la unión de varios polipéptidos y a veces grupos prostéticos.[5]
Un ejemplo de polipéptido es la insulina, compuesta por 51 aminoácidos y conocida como una hormona de acuerdo a la función que tiene en el organismo de los seres humanos.
El enlace peptídico es un enlace covalente entre el grupo amino (–NH2) de un aminoácido y el grupo carboxilo (–COOH) de otro.
Para nombrar un péptido se empieza por el aminoácido que porta el grupo –NH2 terminal, y se termina por el aminoácido que porta el grupo -COOH. En el sistema clásico cada aminoácido se representa por tres letras, y en el moderno, impuesto por la genética molecular, por una letra. Si el primer aminoácido de nuestro péptido fuera alanina y el segundo serina tendríamos el péptido alanil-serina, Ala-Ser, o AS.
Comportamiento ácido-base de los péptidos

Puesto que tienen un grupo amino terminal y un carboxilo terminal, y pueden tener grupos R ionizables, los péptidos tienen un comportamiento ácido-base similar al de los aminoácidos.
Los péptidos, al igual que aminoácidos y proteínas son biomoléculas con un carácter anfótero que permiten la regulación homeostática de los organismos.
Es de destacar este comportamiento en las enzimas, péptidos que funcionan como catalizadores biológicos de las reacciones metabólicas, ya que tienen una capacidad de funcionamiento dentro de ciertos niveles de pH. En caso de superarse se produce una descompensación de cargas en la superficie de la enzima, que pierde su estructura y su función (se desnaturaliza).
Reacciones químicas de los péptidos
Son las mismas que las de los aminoácidos, es decir, las que den respectivamente sus grupos amino, carboxilo y R. Estas reacciones (sobre todo las de los grupos amino y carboxilo) se han empleado para secuenciar péptidos.
Reacciones del grupo amino
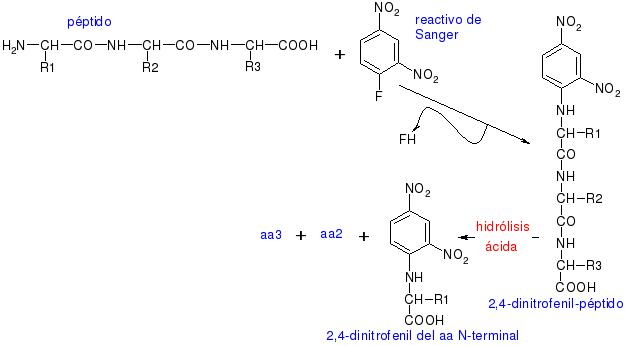
En cuanto a las reacciones del grupo amino, es muy interesante la reacción con el reactivo de Sanger para secuenciar, ya que si tenemos el 2,4-dinitrofenil-péptido y lo hidrolizamos por hidrólisis ácida, se hidrolizarán todos los enlaces peptídicos y obtendremos el dinitrofenil del primer aminoácido de la secuencia, el –NH2 terminal, más el resto de los aminoácidos disgregados en el medio.
Con esta reacción Sanger consiguió secuenciar la insulina.
En esta reacción, el núcleo coloreado de dinitrobenceno se une al átomo de nitrógeno del aminoácido para producir un derivado amarillo, el derivado 2,4-dinitrofenil o DNP-aminoácido. El compuesto DNFB reaccionara con el grupo amino libre del extremo amino de un polipéptido, así como también con los grupos amino de los aminoácidos libres. El enlace C–N que se forma es por lo general mucho más estable que un enlace peptídico. De esta forma, haciendo reaccionar una proteína nativa o un polipéptido intacto con el DNFB, hidrolizando la proteína en ácido y aislando los DNP-aminoácidos coloreados, puede identificarse el grupo amino terminal del aminoácido en una cadena polipeptídica. El grupo amino terminal de la lisina y algunos otros grupos funcionales de las cadenas laterales también reaccionarán con el DNFB.
Sin embargo, después de la hidrólisis, solo el derivado del grupo amino terminal del aminoácido original tendrá su grupo α-amino bloqueado; asimismo, tales DNP-α-aminoácidos pueden separarse de otros derivados DNP mediante procedimientos de extracción simples. Con cualquiera de los variados métodos cromatográficos se podrá identificar a los DNP-α-aminoácidos
Pero este proceso consume mucha energía, ya que, teniendo el primer aminoácido hay que obtener los demás rompiendo por otras zonas. Esto se evita con la degradación de Edman (también es una reacción de aminoácidos): Como la ciclación se da en condiciones ácidas suaves, no se rompen los enlaces, y se da la feniltiohidantoína del aminoácido –NH2 terminal y queda el resto del péptido intacto.
Se separan ambos compuestos y por cromatografía se detecta. Con el resto del péptido se sigue con el mismo procedimiento hasta tener la secuencia completa.
Este método se conoce como degradación de Edman, y es la reacción que usan los secuenciadores automáticos de proteínas. Pero estos secuenciadores solo pueden secuenciar los 20 o 30 primeros aminoácidos, por lo que tendremos que hidrolizar y seguir después. Esto es porque el rendimiento no es del 100% y perdemos péptido poco a poco, y al final no nos queda. Solo las enzimas consiguen un rendimiento al 100%.
Reacciones del grupo carboxilo
También podemos secuenciar empezando por el extremo carboxilo-terminal, para lo que se usan enzimas como la carboxipeptidasa. Es una proteasa que hidroliza los enlaces peptídicos. Ésta en concreto es una exoproteasa (ataca a la proteína por un extremo) que ataca al extremo carboxilo terminal.
Se emplean 2 tipos, la carboxipeptidasa A y B. Catalizan la misma reacción, pero tienen especificidad distinta. La A solo rompe el enlace peptídico si el aminoácido carboxilo-terminal es hidrofóbico. La B lo rompe si es básico.
Hay que controlar muy bien el tiempo de reacción, ya que cuando se libera un carboxilo terminal el siguiente aminoácido se convierte en el carboxilo terminal.
Reacciones de los grupos R
Respecto a las reacciones de los grupos R, existen muchos reactivos que reaccionan de forma específica con determinados grupos R (OH de la serina, tiol de la cisteína...). Esto se usa para ver qué aminoácido es esencial para el funcionamiento de la proteína.
Dentro de las reacciones de los grupos R, una interesante desde el punto de vista de aislamiento y purificación de proteínas es la del grupo tiólico (-SH) de la cisteína, que es fuertemente reductor. En presencia de O2 tiene mucha tendencia a oxidarse. Si hay dos moléculas de cisteína, en presencia de oxígeno, se oxidan para originar una molécula de cistina:
Esto ocurre frecuentemente en una proteína, cuando se pliega y dos moléculas de cisteína quedan próximas en el espacio, generando un puente disulfuro. El puente disulfuro ocurre de forma natural, y debe formarse para estabilizar la estructura tridimensional de las proteínas.
Sin embargo, puede que no deba ocurrir de forma natural, por ejemplo, si hay cisteínas esenciales expuestas (necesarias para la funcionalidad).
Cuando aislamos una proteína de su entorno natural, ponemos a la proteína en presencia de oxígeno, con lo que esos grupos tiólicos se pueden oxidar, y la proteína perder su funcionalidad.
Para evitar esto, en los medios de aislamiento y purificación de proteínas añadimos β-mercapto-etanol, cuyo grupo tiólico es más reductor que el de la propia cisteína; tiene más tendencia a oxidarse.
De modo que al añadir β-mercapto-etanol, este se oxida y protege así los grupos tiólicos de la cisteína.
Cuando queremos estudiar la composición de aminoácidos de una proteína tenemos que hidrolizarla completamente, con lo que tenemos una mezcla de todo el conjunto de aminoácidos libres que constituyen dicha proteína.
Para evitar, en toda esta manipulación, que las Cys que tengamos en el medio se oxiden, tenemos que proteger su grupo tiólico añadiendo como reactivo iodoacetato:
Así transformamos la cisteína en carboximetilcisteína.
Véase también
- Secuencia de aminoácidos
- Neuropéptido
- Biuret
- Péptido de síntesis ribosomal
- Péptido de síntesis no ribosomal
Referencias
- ↑ OMS,OPS,BIREME (ed.). «Aminoácidos, Péptidos y Proteínas». Descriptores en Ciencias de la Salud. Biblioteca Virtual en Salud.
- ↑ «3AA-11 to 3AA-13». iupac.qmul.ac.uk. Consultado el 16 de octubre de 2024.
- ↑
- ↑ «What Is the Difference Between a Peptide and a Protein?». Britannica.
- ↑ a b Nelson, D. L; Cox, M. M. (2018). «3 Aminoácidos, péptidos y proteínas». Lehninger. Principios de Bioquímica (7.ª ed.). Omega. pp. 86-88. ISBN 9788428216678.
- ↑ a b «cap.4: Péptido y Enlace peptídico». Universidad de Murcia.
- ↑ a b «Péptido». National Human Genome Research Institute. NIH. 2023.
- ↑ a b «Explainer: Peptides vs proteins - what's the difference?». Universidad de Queensland. 2017.
- ↑ «Définitions: Polypeptide». Encyclopedie Larousse (en francés).
- ↑ Cuq J-L. «Biochimie des protéines» (PDF) (en francés). Polytech Montpellier. Université de Montpellier.
- ↑ Aswaoui R. Peptides, caractéristiques et structure des protéines. Faculté de médecine. Université d’Oran.
- ↑ Part 1, Section C: PEPTIDE NOMENCLATURE 3AA-11. DEFINITION OF PEPTIDES. «Nomenclature and Symbolism for Amino Acids and Peptides.». IUPAC (en inglés).