
La técnica de Schiff es una reacción colorimétrica que se usa comúnmente en Histoquímica. Utiliza PAS, ácido peryódico de Schiff, o leucofucsina, un colorante incoloro, pero que se torna rojo estable al contacto con los grupos aldehídos.
La técnica de PAS se utiliza en el laboratorio dentro de los preparados para microscopía óptica, permitiendo la tinción de componentes celulares que contienen hidratos de carbono, por ejemplo algunas membranas celulares, células caliciformes en la mucosa del intestino, fibras reticulares que están rodeados por hidratos de carbono, etc. Entonces en esta técnica, el ácido peryódico oxida a los grupos hidroxilo (–OH) de dos carbonos cercanos, formando de esta manera grupos aldehídos compuestos por carbono, oxígeno e hidrógeno. Así la leucofucsina puede reaccionar con estos y dejar una tinción rojiza.
Usos
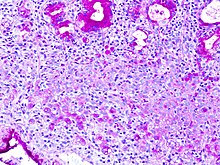


Esta técnica se usa en la tinción de estructuras que contengan una alta proporción de macromoléculas de hidratos de carbono, glicógeno, glicoproteína, proteoglicano, típicas por ejemplo del tejido conjuntivo, moco, glicocálix y lámina basal. También puede usarse para ayudar en el diagnóstico de varias enfermedades:
- Glucogenosis (frente a otros trastornos de almacenamiento).
- Adenocarcinomas, que a menudo secretan mucinas neutras.
- Enfermedad del seno de Paget.[1]
- Sarcoma alveolar de las partes blandas.
- Tinción de macrófagos en la enfermedad de Whipple.[2]
- Puede usarse en diagnóstico de deficiencia de alfa-1 antitripsina si los hepatocitos del hígado se tiñen positivamente.
- Los agregados de linfocitos PAS-positivos están presentes en la epidermis en la Micosis fungoide y en el Síndrome de Sezary, llamados microabcesos Pautrier.
- Sarcoma de Ewing.
- Eritroleucemia, una leucemia de los glóbulos rojos inmaduros, que se tiñen de color fucsia brillante.
- Proteinosis alveolar pulmonar.
- Infección fúngica. Las paredes celulares de los hongos vivos se tiñen de magenta.
- Usada para identificar el glicógeno en muestras de biopsias de pulmón de lactantes con glicogenosis intersticial pulmonar (PIG).
- Se puede usar para resaltar inclusiones de lípidos super-reticulados en Ceroidolipofuscinosis (NCL).
La tinción PAS también se usa para teñir la celulosa.
Si la tinción PAS se lleva a cabo sobre el tejido, el fijador recomendado es formaldehído al 10 % tamponado neutro. Para frotis de sangre, el fijador recomendado es metanol. No se recomienda el glutaraldehído, porque los grupos aldehídos libres pueden reaccionar con el reactivo de Schiff, y dar como resultado falsos positivos de tinción.[3]
Referencias
- ↑ Thomas J. Lawton (27 de abril de 2009). Breast. Cambridge University Press. pp. 55-. ISBN 978-0-521-88159-3. Consultado el 16 de noviembre de 2010.
- ↑ C. Hauser (29 de agosto de 2005). Mayo Clinic Gastroenterology and Hepatology Board Review. CRC Press. pp. 108-. ISBN 978-0-203-50274-7. Consultado el 16 de noviembre de 2010.
- ↑ Carson, Freida L.; Hladik, Christa (2009). Histotechnology: A Self-Instructional Text (3 edición). Hong Kong: American Society for Clinical Pathology Press. pp. 137-139. ISBN 978-0-89189-581-7.








