La teoría del campo de los ligantes (TCL) describe el enlace, disposición de orbitales y otras características de los complejos de coordinación.[1] Representa una aplicación de la teoría del orbital molecular a los complejos de metales de transición. Un ion de metal de transición tiene nueve orbitales atómicos de valencia, cinco nd, un (n+1)s, y tres (n+1)p. Estos orbitales son de una energía apropiada para formar interacciones enlazantes con ligandos. El análisis por TCL es altamente dependiente de la geometría del complejo, pero muchas explicaciones empiezan describiendo complejos octaédricos, donde seis ligandos coordinan al metal.[2]
Historia
[editar]La teoría del campo de ligandos fue desarrollada durante la década de 1930 y 1940 como una alternativa a la teoría del campo cristalino (TCC). La TCC es muy adecuada para el estudio de los espectros electrónicos, magnetismo y resonancia de espín electrónico de los complejos de coordinación, pero al ignorar el efecto del enlace covalente entre los ligandos y el metal, ya que está basado en un modelo que enfatiza las interacciones electrostáticas entre los electrones de los ligandos o ligantes con los electrones de los orbitales vacíos d del metal, es una teoría con muchas limitaciones.En cierto sentido, la TCL combinó la TCC y la emergente teoría del orbital molecular, aunque se trata de otra teoría con limitaciones, ya que asume que el enlace entre el metal y los ligandos es esencialmente covalente, producido por el solapamiento de los orbitales s, p y d del metal central y los orbitales de grupo de los ligandos de la simetría adecuada, sin tener en cuenta las cargas ni los estados de oxidación.[3][4]
Enlace σ
[editar]En esta teoría, cada geometría molecular tiene sus orbitales moleculares, por lo que el enlace σ dependerá de si tenemos un grupo puntual octaédrico (Oh), tetraédrico (Td), etc. Los orbitales moleculares creados por coordinación en el complejo octaédrico pueden verse como resultantes de la donación de dos electrones por cada uno de los seis ligandos dadores σ a los orbitales d vacíos del metal. La aproximación de los ligandos a lo largo de los ejes x, y y z, hace que sus orbitales de simetría σ formen combinaciones enlazantes y antienlazantes con los orbitales dz2 y dx2−y2 (con simetría eg). Los orbitales dxy, dxz y dyz (simetría t2g) permanecen como no enlazantes al no tener la simetría adecuada. Algunas interacciones débiles enlazantes (y antienlazantes) con los orbitales s (simetría a1g) y p (simetría t1u) del metal también tienen lugar, para hacer un total de 6 orbitales enlazantes y 6 antienlazantes.[5]
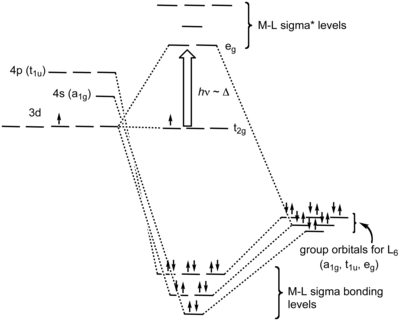
En términos de simetría molecular, los seis orbitales de pares solitarios de los ligandos (uno de cada ligando) forman seis combinaciones de orbitales lineales adaptados simétricamente (COL), también llamados grupos de orbitales ligantes (GOL). Las representaciones irreductibles que surgen son a1g, t1u y eg. El metal también tiene seis orbitales de valencia de los que surgen estas representaciones irreductibles - el orbital s es denominado a1g, un conjunto de orbitales p es denominado t1u, y los orbitales dz2 y dx2−y2 son etiquetados como eg. Los seis orbitales moleculares σ enlazantes resultan de la combinación de los COL con los orbitales del metal de la misma simetría.
Enlace π
[editar]El enlace π en complejos octaédricos sucede en dos formas: vía cualquier orbital p del ligando que no está siendo usado en un enlace σ, y vía cualquier orbital molecular π o π* presente en el ligando.
Los orbitales p del metal se usan para enlaces σ (tienen una simetría no apropiada para traslaparse de cualquier forma con los orbitales p o π o π*), de tal forma que las interacciones π tienen lugar con los orbitales d adecuados del metal, por ejemplo dxy, dxz y dyz. Estos son los orbitales que son no enlazantes cuando sólo está presente el enlace σ.
Un enlace π importante en complejos de coordinación es el enlace π del metal aligando, también llamado retrodonación π. Sucede cuando los LUMO del ligando son orbitales antienlazantes π*. Estos orbitales están próximos en energía a los orbitales dxy, dxz y dyz, con los que se combinan para formar orbitales enlazantes (esto es, orbitales de menor energía que el conjunto previamente mencionado de orbitales d). Los orbitales antienlazantes correspondientes son de mayor energía que los orbitales antienlazantes del enlace σ, así que después que se llenan los nuevos orbitales π con electrones de los orbitales d del metal, ΔO se ha incrementado y el enlace entre el ligando y el metal se hace más fuerte. Los ligandos terminan con electrones en sus orbitales moleculares π*, así que el enlace π correspondiente dentro del ligando se debilita.
La otra forma de enlace de coordinación π es el enlace ligante a metal. Esta situación surge cuando los orbitales de simetría π (p o π) en los ligantes están llenos. Se combinan con los orbitales dxy, dxz y dyz del metal y donan electrones al orbital enlazante de simetría π entre él y el metal. El enlace metal-ligante está algo fortalecido por esta interacción, pero el orbital molecular de antienlace complementario del enlace ligante a metal no es más alto en energía que el orbital molecular de antienlace del enlace σ. Sin embargo, está lleno con electrones de los orbitales d del metal, convirtiéndose en el HOMO del complejo. Por esta razón, ΔO disminuye cuando se forma el enlace ligante a metal.
La mayor estabilización que resulta de un enlace metal a ligante está causada por la donación de carga negativa fuera del ion metálico, hacia los ligantes. Esto permite al metal aceptar los enlaces σ más fácilmente. La combinación de enlace σ ligante a metal y enlace π metal a ligante es un efecto sinergético, puesto que uno mejora al otro.
Como cada uno de los seis ligantes tiene dos orbitales de simetría π, hay doce en total. Las combinaciones lineales de simetría adaptada de estos cae en cuatro representaciones irreductibles triplemente degeneradas, una de las cuales es de simetría t2g. Los orbitales dxy, dxz y dyz del metal también tienen esta simetría, así que los enlaces π formados entre un metal central y seis ligantes también la tienen (puesto que estos enlaces π se forman por el traslape de los dos conjuntos de orbitales con simetría t2g).
Spin alto y bajo, y la serie espectroquímica
[editar]Los seis orbitales moleculares enlazantes que son formados están "llenos" con los electrones de los ligandos, y los electrones de los orbitales d del ion metálico ocupan los orbitales moleculares no enlazantes y, en algunos casos, los antienlazantes. La diferencia de energía entre los dos últimos tipos de orbitales moleculares es denominada ΔO (O por octaédrica) y está determinada por la naturaleza de la interacción π entre los orbitales ligantes con los orbitales d del átomo central. Los ligandos donante π conducen a un valor pequeño de ΔO y son denominados ligandos de campo débil o bajo, mientras que los ligandos aceptores π conducen a un valor grande de ΔO y son denominados ligandos de campo fuerte o alto. Los ligandos que no son ni donantes π ni aceptores π producen un valor de ΔO en un punto medio.
El tamaño de ΔO determina la estructura electrónica de los iones d4 - d7. En complejos con metales con estas configuraciones electrónicas d, los orbitales moleculares de no enlace y antienlace pueden ser llenados en dos formas: una en la que tantos electrones como sean posibles entran en los orbitales no enlazantes antes de empezar a llenar los orbitales antienlazantes, y otra en la que entran tantos electrones desapareados como sea posible. El primer caso es llamado de spin bajo, mientras que el último es llamado de spin alto. Un valor pequeño de ΔO puede sobrevenir de la ganancia energética de los electrones no apareados, que conduce a un spin alto. Sin embargo, cuando ΔO es grande, la energía de apareamiento de spin se vuelve insignificante en comparación y surge el estado de spin bajo.
La serie espectroquímica es una lista derivada empíricamente de ligandos ordenados por el tamaño de Δ que producen. Puede verse que los ligandos de campo bajo son todos donantes π (como el I-), los ligantes de campo alto son aceptores π (como el CN- y CO), y los ligantes como H2O y NH3, que son ninguno de ellos, están en el medio.[2]
I− < Br− < S2− < SCN− < Cl− < NO3− < N3− < F− < OH− < C2O42− < H2O < NCS− < CH3CN < py (piridina) < NH3 < en (etilendiamina) < bipy (2,2'-bipiridina) < phen (1,10-fenantrolina) < NO2− < PPh3 < CN− < CO
Referencias
[editar]- ↑ Schläfer, H. L.; Gliemann, G. "Basic Principles of Ligand Field Theory" Wiley Interscience: New York; 1969
- ↑ a b G. L. Miessler and D. A. Tarr “Inorganic Chemistry” 3rd Ed, Pearson/Prentice Hall publisher, ISBN 0-13-035471-6.
- ↑ Griffith, J.S. and L.E. Orgel. "Ligand Field Theory". Q. Rev. Chem. Soc. 1957, 11, 381-393
- ↑ Ribas Gispert, Joan (2000). Química de coordinación. Omega. p. 55. ISBN 84-282-1210-4.
- ↑ Frenking, Gernot; Shaik, Sason, eds. (May 2014). «Chapter 7: Chemical bonding in Transition Metal Compounds». The Chemical Bond: Chemical Bonding Across the Periodic Table. Wiley -VCH. ISBN 978-3-527-33315-8.








