| Tetrahidroisoquinolina | ||
|---|---|---|
  | ||
| Nombre IUPAC | ||
| 1,2,3,4-tetrahidroisoquinolina | ||
| General | ||
| Otros nombres | THIQ | |
| Fórmula semidesarrollada | C9H11N | |
| Fórmula estructural |
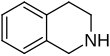 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 91-21-4[1] | |
| Número RTECS | NX4900000 | |
| ChEBI | 125498 | |
| ChEMBL | CHEMBL14346 | |
| ChemSpider | 6779 | |
| PubChem | 7046 | |
| UNII | 56W89FBX3E | |
| Propiedades físicas | ||
| Apariencia | amarillo oscuro | |
| Densidad | 1,05 kg/m³; 0,00105 g/cm³ | |
| Masa molar | 133,19 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La THIQ, o 1,2,3,4-tetrahidroisoquinolina según IUPAC, es un compuesto orgánico heterocíclico cuya fórmula molecular es C9H11N. Es un líquido de color amarillo oscuro a temperatura ambiente, ligeramente más denso que el agua y soluble en éste.
Síntesis
La THIQ se puede sintetizar de diversas formas, pero solo unos pocos llevan a la THIQ sin sustituir. Uno de ellos, consiste en la reacción de Pomeranz-Fritsch, que parte de benzaldehido y del aminoacetoaldehido dietil acetal, que en medio ácido forma la isoquinolina, que posteriormente se hidrogena en presencia de platino soportado sobre carbono como catalizador, para formar la THIQ sin sustituir.
Otros diversos métodos se usan para obtener derivados de THIQ.[2][3]
THIQ en la naturaleza
Se sabe que la THIQ se presenta en la naturaleza unida a otros grupos aromáticos y heterocíclicos. Como ejemplo se muestra la siguiente estructura:
Su nombre sistemático de acuerdo con la IUPAC es, en inglés, N-[(3R)-1,2,3,4-tetrahydroisoquinolinium-3-ylcarbonyl]-(1R)-1-(4-chlorobenzyl)-2-[4-cyclohexyl-4-(1H-1,2,4-triazol-1ylmethyl)piperidin-1-yl]-2-oxoethylamine. Fue encontrada en seres vivos como receptor de estímulos sexuales,[4] y en la actualidad se está estudiando su posible relación con enfermedades como el Parkinson o el Alzheimer.[5]
Reacciones
Como cualquier amina secundaria, puede ser oxidada a la correspondiente nitrona, usando H2O2, con SeO2 como catalizador.[6] También pueden ser transformadas en guanidinas por métodos estándar.[7]
THIQ y el ser humano
La estructura THIQ se puede encontrar comúnmente en diversos productos farmacéuticos. Los variados derivados de THIQ poseen múltiples propiedades y efectos sobre el ser humano, como pueden ser:
- Antihipertensivos[7]
- Bloqueantes de receptores adrenérgicos[8]
- Actividad antiglioma[9]
Algunos derivados como el norsalsolinol están siendo investigados como posible causa de algunas enfermedades como el Parkinson.[10]
Otro de los efectos estudiados de esta sustancia son sus efectos adictivos en personas que padecen alcoholismo. Se sabe que cuando ingerimos alcohol nuestro cuerpo lo convierte primero en acetaldehído el cual reacciona químicamente con los neurotransmisores produciendo THIQ. En función del neurotransmisor con que se combine se pueden formar diferentes tipos de THIQs.
Estudios realizados en monos y ratas de laboratorio, a los que les inyectaba THIQ en el cerebro, demostraban que éstos desarrollaban un apetito intenso por el alcohol, aun a pesar de que antes de haberles inyectado nada, rechazaban el alcohol, prefiriendo el agua.
Referencias
- ↑ Número CAS
- ↑ 3,4-Dihydroisocarbostyril and 1,2,3,4-tetrahydroisoquinoline derivatives of ephedrine Donald L. Trepanier, Shyam Sunder J. Med. Chem., 1973, 16 (4), pp 342–347
- ↑ Derivados de THIQ Archivado el 4 de marzo de 2016 en Wayback Machine.
- ↑ Shadiack AM, Sharma SD, Earle DC, Spana C, Hallam TJ (2007). "Melanocortins in the treatment of male and female sexual dysfunction". Current Topics in Medicinal Chemistry 7 (11): 1137–44. doi:10.2174/156802607780906681. PMID 17584134.
- ↑ King SH, Mayorov AV, Balse-Srinivasan P, Hruby VJ, Vanderah TW, Wessells H (2007). "Melanocortin receptors, melanotropic peptides and penile erection". Current Topics in Medicinal Chemistry 7 (11): 1098–1106. PMID 17584130.
- ↑ Murahashi, S. (1987). "Selenium dioxide catalyzed oxidation of secondary amines with hydrogen peroxide. Simple synthesis of nitrones from secondary amines". Tetrahedron Letters 28: 2383–2386. doi:10.1016/S0040-4039(00)96130-6
- ↑ a b 1,2,3,4-Tetrahydroisoquinoline Derivatives with Antihypertensive Properties. Wilhelm Wenner. J. Med. Chem., 1965, 8 (1), pp 125–126
- ↑ 6,7-Dichloro-1-(3,4,5-trimethoxybenzyl)-1,2,3,4-tetrahydroisoquinoline. A structurally novel.beta.-adrenergic receptor blocking agent. Carl Kaiser, Hye Ja Oh, Blanche J. Garcia-Slanga, Anthony C. Sulpizio, J. Paul Hieble, Joyce E. Wawro, Lawrence I. Kruse. J. Med. Chem., 1986, 29 (11), pp 2381–2384
- ↑ Discovery of Antiglioma Activity of Biaryl 1,2,3,4-Tetrahydroisoquinoline Derivatives and Conformationally Flexible Analogues. Michael L. Mohler, Gyong-Suk Kang, Seoung-Soo Hong, Renukadevi Patil, Oleg V. Kirichenko, Wei Li, Igor M. Rakov, Eldon E. Geisert, and Duane D. Miller. J. Med. Chem., 2006, 49 (19), pp 5845–5848
- ↑ Makino, Y; Ohta; Tasaki; Tachikawa; Kashiwasake; Hirobe (1990). "A novel and neurotoxic tetrahydroisoquinoline derivative in vivo: formation of 1,3-dimethyl-1,2,3,4-tetrahydroisoquinoline, a condensation product of amphetamines, in brains of rats under chronic ethanol treatment". Journal of neurochemistry 55 (3): 963–9.
- ↑ THIQ and alcohol Archivado el 25 de junio de 2007 en Wayback Machine.
- ↑ John Wallace, El alcoholismo como enfermedad, Trillas, México, 1a. Edición. 1990.










