La reacción de Abramov son las conversiones relacionadas de trialquilfosfonatos a α-hidroxifosfonatos mediante la adición a compuestos de carbonilo. En términos de mecanismo, la reacción implica el ataque del átomo de fósforo nucleófilo sobre el carbono carbonílico.[1] Lleva el nombre del químico ruso V. S. Abramov (1904-1968), ya que aunque fue descubierta por los químicos rusos A.E. Arbuzov y M.M. Azonovsky, fue estudiado en profundidad por dicho científico.[2]
Introducción
Las fuentes de fósforo ricas en electrones, tales como fosfitos, fosfonitos y fosfinitos, pueden experimentar una adición nucleofílica a los átomos de carbono de los compuestos de carbonilo simples. Cuando se usan fosfitos totalmente esterificados (reacción de Abramov), la neutralización del intermedio tetraédrico resultante generalmente ocurre mediante la transferencia de un grupo alquilo o sililo desde un oxígeno unido al fósforo al centro de alcóxido recién creado. La adición del conjugado también es posible,[3] y proporciona compuestos de carbonilo o éteres de enol γ-funcionalizados después de la transferencia del grupo. El uso de fuentes de fósforo que contienen siloxi ha ampliado enormemente el alcance de esta reacción, ya que los compuestos de α-siloxi resultantes pueden convertirse en los derivados de α-hidroxi correspondientes en presencia de un disolvente alcohólico.[4]

Mecanismo y estereoquímica
Los fosfitos se adicionan reversiblemente al carbono carbonílico de los compuestos carbonílicos simples. En condiciones suaves, la reversión a los materiales de partida es más rápida que la transferencia de grupos alquilo intramolecular e intramolecular: el estado de transición de cuatro centros para la transferencia intramolecular exhibe una superposición orbital deficiente.[5] La transferencia se puede facilitar en condiciones de alta temperatura o presión. Si se usan dos equivalentes de aldehído, la adición del intermedio tetraédrico a una segunda molécula de aldehído conduce a productos fosforanos cíclicos 1 o de transferencia de alquilo lineales 2.
Más práctico es el uso de fuentes de fósforo sililado, que se someten a la transferencia intramolecular de grupos sililo de forma frontal, proporcionando compuestos de fósforo α-siloxi 3.[6]

Alcance y limitaciones
Reactivos de fósforo
Los fosfitos se usan comúnmente para generar α-hidroxifosfonatos. En presencia de dos equivalentes de aldehído, predominan los fosforanos cíclicos 1, pero estos pueden hidrolizarse fácilmente para dar los correspondientes hidroxifosfonatos:[7]
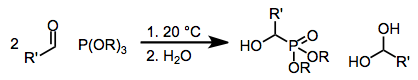
Cuando se emplean fosfonatos en presencia de cantidades catalíticas de base, pueden producirse óxidos de fosfina. Las sales de sodio de los ácidos fosfónicos históricamente han funcionado bien en este contexto, y se han utilizado bases como la amiduro de sodio.[8] Sin embargo, la inducción asimétrica y la adición directa selectiva (para compuestos de carbonilo conjugados) se pueden lograr en presencia de bases de aminas quirales:[9]

El descubrimiento y el uso de reactivos de fósforo sililado en esta reacción representaron un avance metodológico. La transferencia selectiva de grupos sililo ocurre en reactivos mixtos, y la escisión de los enlaces de silicio-oxígeno resultantes a menudo se puede lograr hidrolíticamente, proporcionando acceso a derivados de α-hidroxi. La alquilación de productos de α-siloxi proporciona una ruta conveniente para acceder de otra manera a compuestos de α-alcoxi-organofosforados. Pueden funcionar como aniones de acilo equivalentes cuando se desprotonan, y dan cetonas después de la eliminación en condiciones básicas:[10]

Sustratos carbonílicos
Las cetonas y los aldehídos simples experimentan fácilmente la adición de fosfitos en el carbono carbonílico. En una aplicación interesante, la adición a cetenas da productos idénticos a la reacción de Arbuzov de haluros de ácido.[11]

Las cetonas y los aldehídos α,β-insaturados también sufren la reacción. Los sustratos de dienil carbonilo pueden experimentar adición-1,6, como en el siguiente ejemplo:[12]

Las iminas también pueden sufrir la reacción (reacción de Pudovik), produciendo fosfonatos de α-alquilamina.[13] Las aminas primarias se pueden producir solo después de la hidrólisis ácida de una terc-butilamina intermedia;[14] ya que el uso de iminas no sustituidas requiere condiciones muy duras y proporciona bajos rendimientos:

Utilidad sintética
Los α-hidroxialquilfosfonatos producidos por este método pueden usarse para transformaciones adicionales. El carbono carbonílico original se acidifica por su proximidad al grupo fosfonato. La desprotonación en esta posición genera un anión acilo enmascarado, ya que la funcionalidad de fosfonato se puede eliminar después de la reacción del anión. Los aniones fosfonato pueden experimentar alquilación y olefinación (reacción de Horner–Wadsworth–Emmons).[15] Cuando se emplean α-amino alquilfosfonatos en la olefinación, las enaminas resultantes pueden hidrolizarse a cetonas.
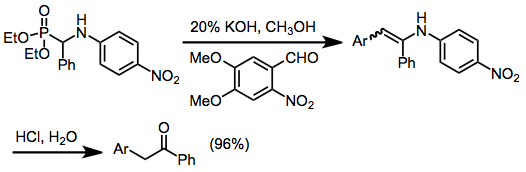
La adición a compuestos de carbonilo insaturados y su desprotonación proporcionan equivalentes de homoenolato.
Comparación con otros métodos
Los reactivos de fosfito sililado son algunos de los más eficientes para la producción de α-hidroxifosfonatos. Sin embargo, existen algunos otros métodos para hacer estos compuestos. Por ejemplo, la trasposición de fosfato-fosfonato proporciona α-hidroxifosfonatos a través de un intermedio cíclico de tres miembros:[16]

Condiciones y procedimientos experimentales
En general, las reacciones de adición de fósforo son operacionalmente simples. Se pueden utilizar disoluciones de los reactivos en disolventes polares (acetonitrilo, etanol, terc-butanol) y no polares (benceno). La catálisis ácida puede ser necesaria para adiciones de diésteres de fosfito o para la formación in situ de iminas. La catálisis básica también se puede emplear en el primer caso. La destilación es generalmente suficiente para aislar productos puros.
Véase también
- Reacción de Michaelis-Arbuzov: la reacción de un trialquilfosfito y un alquil-haluro para formar un fosfonato.
Referencias
- ↑ Engel, R. (2004). «Phosphorus Addition at sp² Carbon». Organic Reactions: 175-248. ISBN 0471264180. doi:10.1002/0471264180.or036.02.
- ↑ Knunyants I.L. et al. (1988). Enciclopedia química. Enciclopedia soviética - T. 1 (Abl-Dar). p. 623.
- ↑ Sekine, M.; Yamamoto, I.; Hashizume, A.; Hata, T. (1977). «Silyl Phosphites V. The Reactions of Tris(Trimethylsilyl) Phosphite with Carbonyl Compounds». Chem. Lett. 6 (5): 485-488. doi:10.1246/cl.1977.485.
- ↑ Ranganathan, D.; Rao, B.; Ranganathan, S. (1979). «Nitroethylene: Synthesis of novel 2-nitroethylphosphonates». J. Chem. Soc., Chem. Commun. (21): 975. doi:10.1039/c39790000975.
- ↑ Ginsberg, A.; Jakubovich, Y. (1960). «none». Zh. Obshch. Khim. 30: 3979.
- ↑ Sommer, H. Stereochemistry, Mechanism and Silicon, McGraw-Hill, New York, 1965, pp. 176–178.
- ↑ Ramirez, F.; Bhatia, B.; Smith, P. (1967). «Reaction of trialkyl phosphites with aromatic aldehydes». Tetrahedron 23 (5): 2067. doi:10.1016/0040-4020(67)80040-1.
- ↑ Pudovik, A.; Arbuzov, A. (1950). «none». Dokl. Akad. Nauk SSSR 73: 327.
- ↑ Wynberg, H.; Smaardijk, A. (1983). «Asymmetric catalysis in carbon-phosphorus bond formation». Tetrahedron Lett. 24 (52): 5899. doi:10.1016/S0040-4039(00)94232-1.
- ↑ Horner, H.; Roder, H. (1970). «Phosphororganische Verbindungen, 67. Notiz über die reduktive Umwandlung von Carbonsäuren in ihre Aldehyde». Chem. Ber. 103 (9): 2984. doi:10.1002/cber.19701030936.
- ↑ Mirsalikhova, M.; Baranova, A.; Tunitskaya, L.; Gulyaev, N. (1981). «none». Biokhimiya 46: 258.
- ↑ Arbuzov, A.; Fuzhenkova, V.; Rozhkova, F. (1982). «none». J. Gen. Chem. USSR 52: 10.
- ↑ Tyka, R. (1970). «Novel synthesis of α-aminophosphonic acids». Tetrahedron Lett. 11 (9): 677-680. doi:10.1016/S0040-4039(01)97800-1.
- ↑ Moedritzer, K. (1970). «A Novel Synthesis of Aminomethylphosphonic Acid». Synth. React. Inorg. Metal-Org. Chem. 2 (4): 317-327. doi:10.1080/00945717208069617.
- ↑ Wadsworth, W. (1977). «Synthetic Applications of Phosphoryl-Stabilized Anions». Org. React. 25: 73-253. ISBN 0471264180. doi:10.1002/0471264180.or025.02.
- ↑ Sturtz, G.; Corbel, B.; Paugam, J.-P. (1976). «Nouveaux synthons phosphores : Bianions d'hydroxy-1 propene-2 YL phosphonamides, carbanions en β d'acides carboxyliques potentiels». Tetrahedron Lett. 17: 47-50. doi:10.1016/S0040-4039(00)71319-0.








