
La reacción de Michaelis–Arbuzov (también llamada la reacción de Arbuzov) es la reacción química de un éster de fósforo trivalente con un halogenuro de alquilo para formar especies de fósforo pentavalente y otro halogenuro de alquilo. La siguiente imagen muestra los tipos más comunes de sustratos sometidos a la reacción de Arbuzov; los ésteres de fosfito (1) reaccionan para dar fosfonatos (2), fosfonitos (3) reaccionan para dar fosfinatos (4) y fosfinitos (5) reaccionan para dar óxidos de fosfina (6).

La reacción fue descubierta por August Michaelis en 1898[1] y Aleksandr Arbuzov la exploró mucho después.[2][3] Esta reacción se usa ampliamente para la síntesis de varios fosfonatos, fosfinatos y óxidos de fosfina. Se han publicado varias revisiones.[4][5] La reacción también ocurre para los ligandos de fosfito coordinados, como lo ilustra la desmetilación de {(C5H5)Co[(CH3O)3P]3}2+ para dar {(C5H5)Co[(CH3O)2PO]3}−, que se llama ligando de Kläui.
Mecanismo de reacción
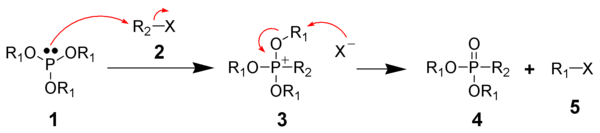
La reacción de Michaelis-Arbuzov se inicia con el ataque SN2 de las especies de fósforo nucleófilo (1) con el haluro de alquilo electrófilo (2) para dar una sal de fosfonio como intermedio de reacción (3). Estos intermedios son ocasionalmente lo suficientemente estables como para aislarse, como los fosfatos de triarilo, que no reaccionan para formar el fosfonato sin la escisión térmica del intermedio (200 °C), o escisión por alcoholes o bases. El anión de haluro desplazado, generalmente reacciona a través de otra reacción SN2 en uno de los carbonos R1, desplazando el átomo de oxígeno para dar el fosfonato deseado (4) y otro haluro de alquilo (5). Esto ha sido respaldado por la observación de que los grupos R1 quirales experimentan una inversión de configuración en el centro de carbono atacado por el anión haluro (esto es lo que se espera de una reacción SN2).[6] También existe evidencia de un mecanismo de desalquilación basado en la formación de un carbocatión similar a una reacción SN1, donde el grupo R1 se disocia inicialmente de la sal de fosfonio seguido del ataque del anión.[5] Los ésteres de fosfito con grupos haluro de alquilo terciario, pueden sufrir la reacción, lo que sería inesperado si solo estuviera funcionando un mecanismo SN2. El apoyo adicional para este mecanismo de tipo SN1 proviene del uso de la reacción de Arbuzov en la síntesis de haluros de neopentilo, una clase de compuestos que son notoriamente no reactivos frente a las reacciones de SN2. Basado en el principio de reversibilidad microscópica, la naturaleza inerte de los haluros de neopentilo hacia la reacción SN2 indica que es poco probable que una reacción SN2 sea el mecanismo para la síntesis de los haluros de neopentilo en esta reacción. Los sustratos que no pueden reaccionar a través de una ruta SN2 o una ruta SN1 generalmente no reaccionan, lo que incluye grupos vinilo y arilo. Por ejemplo, los fosfitos de triarilo mencionados anteriormente, generalmente no reaccionan, porque forman sales de fosfonio estables. Dado que los grupos arilo no experimentan mecanismos de tipo SN1 ni SN2, los fosfitos de triarilo carecen de una vía de baja energía para la descomposición de la sal de fosfonio. También se ha implicado un mecanismo de reordenamiento alílico (SN2') en haluros alílicos y propargílicos.
Experimentos estereoquímicos en fosfitos cíclicos, han revelado la presencia de fosforanos pentavalentes e intermedios de fosfonio tetravalente en equilibrio químico, involucrados en la etapa de desalquilación de la reacción usando 31P-RMN. La descomposición de estos intermedios está impulsada principalmente por la nucleofilicidad del anión. Existen muchos casos en los que las sales intermedias de fosfonio son lo suficientemente estables como para que puedan aislarse cuando el anión es débilmente nucleófilo, como con los aniones tetrafluoroborato o triflato.
Alcance
Halogenuro de alquilo[5]
Como pauta general, la reactividad del componente de haluro orgánico se puede enumerar de la siguiente manera: (de más reactivo a menos reactivo)
y
En general, los haluros de alquilo terciarios, los haluros de arilo y los haluros de vinilo no reaccionan. Existen notables excepciones a esta tendencia, incluidos el 1,2-dicloroeteno y los haluros de tritilo. Se sabe que algunos haluros de arilo activados, que a menudo implican heterociclos, experimentan la reacción. Se sabe que el yodobenceno y los derivados sustituidos, experimentan la reacción en condiciones fotolíticas. Los haluros de alquilo secundarios a menudo no reaccionan bien, produciendo olefinas como productos secundarios. Los haluros de alilo y propargilo también son reactivos, pero pueden proceder a través de un mecanismo SN2 o SN2'. La reacción con haluros de alquilo primarios y haluros de acilo generalmente se realiza sin problemas. El tetracloruro de carbono, curiosamente, solo sufre la reacción una sola vez con cloroformo inerte a las condiciones de reacción. Cuando se encuentra un átomo de haluro en la cadena de éster fuera del átomo de fósforo, se conoce la isomerización en el producto Arbuzov correspondiente sin la adición de un haluro de alquilo.
La reacción de Perkow es una vía de reacción competitiva para las α-bromo y α-clorocetonas. En las condiciones de reacción, se produce una mezcla del producto Perkow y el producto Arbuzov normal, que generalmente favorece al producto Perkow en una cantidad significativa. Usar temperaturas más altas durante la reacción puede conducir a favorecer el producto Arbuzov. La reacción de las α-yodocetonas solo da el producto Arbuzov.[7] Se han desarrollado otros métodos para producir β-cetofosfonatos.[8]
La reacción de los compuestos de fósforo trivalente con haluros de alquilo donde el haluro es flúor no es habitual. Un ejemplo de esta reactividad se muestra a continuación:

Reactivo de fósforo[5]
La forma general del reactivo de fósforo trivalente se puede considerar de la siguiente manera: con A y B generalmente siendo alquilo, alcoxi o grupos ariloxi. Se sabe que los grupos electroatractores reducen la velocidad de la reacción, y los grupos electrodadores aumentan la velocidad de la reacción. Esto es consistente con el ataque inicial del reactivo de fósforo en el haluro de alquilo como el paso determinante de la velocidad de la reacción. La reacción continúa suavemente cuando el grupo R es alifático. Cuando todos A, B y R son grupos arilo, se forma una sal de fosfonio estable y la reacción no continúa en condiciones normales. Se sabe que el calentamiento a temperaturas más altas en presencia de alcoholes proporciona el producto de isomerización. Los fosfitos cíclicos generalmente reaccionan para expulsar el grupo OR no cíclico, aunque para algunos anillos de 5 miembros se requiere un calentamiento adicional para proporcionar el producto cíclico final:

Las sales de fosfito (Ej: R=Na) también pueden sufrir la reacción con precipitación de la sal de haluro de sodio correspondiente. Los amidofosfitos y los sililoxifosfitos se han utilizado antes para producir amidofosfonatos y ácidos fosfínicos:

Un reordenamiento de tipo Arbuzov también puede ocurrir donde el O de un grupo OR actúa como el grupo saliente en el ataque inicial SN2 del fósforo. Esto solo se sabe que ocurre cuando A y B son Cl:

Los ésteres de fosfito son la clase menos reactiva de reactivos utilizados en esta reacción. Reaccionan para producir fosfonatos. Requieren el mayor calentamiento para que se produzca la reacción (120 °C - 160 °C es común). Esta alta temperatura permite que se emplee la destilación fraccionada en la eliminación del haluro de alquilo producido, aunque también se puede usar un exceso del haluro de alquilo de partida. Los disolventes a menudo no se usan para esta reacción, aunque existen precedentes para la mejora de la selectividad con su uso:

Los fosfonitos son generalmente más reactivos que los ésteres de fosfito. Reaccionan para producir fosfinatos. También se requiere calentamiento para la reacción, pero la pirólisis del éster a un ácido es una reacción secundaria común. La escasa disponibilidad de fosfonitos sustituidos limita el uso de esta clase de reactivo en la reacción de Arbuzov. Los grupos funcionales hidroxi, tiol, ácido carboxílico, amina primaria y secundaria no pueden usarse con fosfonitos en la reacción ya que todos reaccionan con el fosfonito.
Los fosfinitos son la clase más reactiva de reactivos utilizados en esta reacción. Reaccionan para producir óxidos de fosfina. A menudo requieren muy poco calentamiento (45 °C) para que ocurra la reacción y se sabe que se auto-isomerizan sin la presencia de haluros de alquilo.
Véase también
Referencias
- ↑ Michaelis, A.; Kaehne, R. (1898). «Ueber das Verhalten der Jodalkyle gegen die sogen. Phosphorigsäureester oder O-Phosphine». Berichte 31: 1048-1055. doi:10.1002/cber.189803101190.
- ↑ Arbuzov, A. E. (1906). «Reactions of alkyl halides with phosphites». J. Russ. Phys. Chem. Soc. 38: 687.
- ↑ Arbuzov, A. E. (1906). «On the Structure of Phosphorous Acid and Its Derivatives, Isomerization and transition of bonds from trivalent to pentavalent phosphorus». Chem. Zentr. II: 1639.
- ↑ Arbuzov, B. A. (1964). «Michaelis–Arbusow- und Perkow-Reaktionen». Pure Appl. Chem. 9 (2): 307-353. doi:10.1351/pac196409020307.
- ↑ a b c d Bhattacharya, A. K.; Thyagarajan, G. (1981). «Michaelis–Arbuzov rearrangement». Chem. Rev. 81 (4): 415-430. doi:10.1021/cr00044a004.
- ↑ Gerrard, W.; Green, W. J. (1951). «568. Mechanism of the formation of dialkyl alkylphosphonates». J. Chem. Soc.: 2550. doi:10.1039/jr9510002550.
- ↑ Jacobsen, H. I.; Griffin, M. J.; Preis, S.; Jensen, E. V. (1957). «Phosphonic Acids. IV. Preparation and Reactions of β-Ketophosphonate and Enol Phosphate Esters». J. Am. Chem. Soc. 79 (10): 2608. doi:10.1021/ja01567a067.
- ↑ Nagata, W.; Wakabayashi, T.; Hayase, Y. (1988). "Diethyl 2-(cyclohexylamino)vinylphosphonate". Org. Synth.; Coll. Vol. 6: 448.











