
La reacción SN2 (conocida también como sustitución nucleofílica bimolecular o como ataque desde adelante) es un tipo de sustitución nucleofílica, donde un par de electrones libres de un nucleófilo ataca un centro electrofílico y se enlaza a él, expulsando otro grupo denominado grupo saliente. En consecuencia, el grupo entrante reemplaza al grupo saliente en una etapa. Dado que las dos especies reaccionantes están involucradas en esta etapa limitante lenta de la reacción química, esto conduce al nombre de sustitución nucleofílica bimolecular, o SN2. Entre los químicos inorgánicos, la reacción SN2 es conocida frecuentemente como el mecanismo de intercambio.
Mecanismo de la reacción
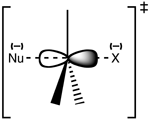
La reacción ocurre más frecuentemente en un centro de carbono alifático hibridado en sp3, con un grupo saliente estable electronegativo - 'L' - frecuentemente un átomo halogenuro. La ruptura del enlace C-L, y la formación del nuevo enlace C-Nu sucede simultáneamente para formar un estado de transición en el que el carbono bajo ataque nucleofílico está pentacoordinado, en una hibridación aproximadamente sp2. El nucleófilo ataca al carbono a 180° del grupo saliente, puesto que esto proporciona el mejor traslape entre el par libre del nucleófilo, y el orbital antienlazante σ* C-L. El grupo saliente es liberado del lado opuesto, y se forma el producto.
Si el sustrato bajo ataque nucleofílico es quiral, la reacción conduce a una inversión de la estereoquímica, denominada inversión de Walden.

En un ejemplo de la reacción SN2, el ataque del OH− (el nucleófilo) en un bromoetano (el electrófilo) resulta en etanol, con bromuro liberado como el grupo saliente.
El ataque SN2 ocurre si la ruta de atrás del ataque no está bloqueada estéricamente por sustituyentes en el sustrato. En consecuencia, este mecanismo sucede usualmente en un centro carbono primario descubierto. Si hay hacinamiento estérico en el sustrato, cerca al grupo saliente, tal como un centro carbono terciario, la sustitución involucrará un mecanismo SN1, en vez de SN2 (una SN1 sería más probable en este caso, debido a que se podría formar un intermediario carbocatiónico suficientemente estable).
En química de coordinación, la sustitución asociativa procede por medio de un mecanismo similar al SN2.
Factores que afectan a la reacción sn2
La basicidad del grupo saliente. Al comparar la velocidad de reacción SN2 de compuestos con átomos en el mismo grupo periódico (por ejemplo, los halogenuros), los resultados muestran que la habilidad como grupo saliente durante una reacción SN2 depende de su basicidad. En general, a menor basicidad de un grupo, mayor es su capacidad como grupo saliente. Por ejemplo, el ion yoduro es una base muy débil, y debido a esto, es un excelente grupo saliente. Las bases débiles no comparten bien sus electrones, debido a que están muy lejos del núcleo, lo que hace que sus enlaces sean fáciles de romper. En contraste, el ion fluoruro es una base más fuerte que los otros halogenuros y, en consecuencia, es más difícil que se comporte como grupo saliente. En efecto, el ion fluoruro es una base tan fuerte que los compuestos que lo contienen esencialmente no sufren reacción SN2. Observando la tabla periódica, la basicidad relativa decrece hacia abajo en un grupo.
- (Base más fuerte) F- > Cl- > Br- > I- (Base más débil)
El tamaño del nucleófilo. Cuánto fácilmente un compuesto ataca a un átomo deficiente en electrones también afecta a una reacción SN2. Como regla, las especies cargadas negativamente (por ejemplo, OH -) son mejores nucleófilos que las especies neutras (por ejemplo, H2O, agua). Hay una relación directa entre basicidad y nucleofilicidad: las bases más fuertes son mejores nucleófilos.
Solvente. Si una reacción es llevada a cabo en un solvente prótico, cuyas moléculas tienen un átomo de hidrógeno enlazado a un oxígeno o nitrógeno, el átomo más grande es un mejor nucleófilo en una reacción SN2. En otras palabras, la base más débil es el mejor nucleófilo en un solvente prótico. Por ejemplo, el ion yoduro es mejor que el fluoruro como nucleófilo. Sin embargo, si la reacción es llevada a cabo en un solvente aprótico, cuyas moléculas no tienen hidrógeno enlazado a un oxígeno o a un nitrógeno, la base más fuerte es el mejor nucleófilo. En este caso, el ion fluoruro es mejor que el ion yoduro como nucleófilo.
Efectos estéricos. El impedimento estérico es cualquier efecto de un compuesto, debido al tamaño o posición de los grupos sustituyentes. Los efectos estéricos afectan a la nucleofilicidad, pero no afectan la fuerza de la base. Un nucleófilo voluminoso, como el ion tert-butóxido con su arreglo específico de grupos metilo, es un nucleófilo más pobre que el ion etóxido, con una cadena lineal de carbonos, incluso aunque el tert-butóxido es una base más fuerte.
Cinética de la reacción
La velocidad de una reacción SN2 es de segundo orden, puesto que la etapa limitante depende de la concentración del nucleófilo, [Nu−] así como de la concentración del sustrato, [RX].
- r = k[RX][Nu−]
Ésta es una diferencia clave entre los mecanismos SN1 y SN2. En la reacción SN1, el nucleófilo ataca después de que finaliza la etapa limitante de la reacción, mientras que en la reacción SN2, el nucleófilo fuerza la salida del grupo saliente en la etapa limitante. En otras palabras, la velocidad de las reacciones SN1 depende solamente de la concentración del sustrato, mientras que la reacción SN2 depende de la concentración del sustrato y el nucleófilo. En los casos donde son posibles ambos mecanismos (por ejemplo, en un centro de carbono secundario), el mecanismo depende del solvente, la temperatura, concentración del nucleófilo o las características del grupo saliente.
Las reacciones SN2 son favorecidas generalmente en halogenuros de alquilo primarios o secundarios, con un solvente aprótico. Se llevan a cabo a una velocidad despreciable en halogenuros de alquilo terciarios, debido al impedimento estérico.
Es importante entender que las reacciones SN2 y SN1 son dos extremos en la escala continua de mecanismos de reacción para los procesos de sustitución, es posible encontrar muchas reacciones que muestran tanto un carácter SN2 como carácter SN1 en sus mecanismos. Por ejemplo, es posible encontrar un par iónico formado a partir de un halogenuro de alquilo en el que los iones no están completamente separados: cuando estos sufren sustitución la estereoquímica se invertirá (como en SN2) para muchas de las moléculas reaccionantes, pero unas pocas mostrarán retención de la configuración.
Competencia con E2
Una reacción secundaria común que se presenta en las reacciones SN2 es la eliminación E2: el anión entrante puede actuar como una base en vez de como un nucleófilo, sustrayendo un protón, y conduciendo a la formación del alqueno. Este efecto puede ser demostrado en la reacción en fase gaseosa entre un sulfonato y un bromuro de alquilo que tiene lugar en el interior de un espectrómetro de masas:[1][2]
Con el bromuro de etilo, el producto de reacción es predominantemente el producto de sustitución. A la par con el incremento del impedimento estérico alrededor del centro electrofílico, como con el bromuro de isobutilo, la sustitución es desfavorecida, y la eliminación es la reacción predominante. Otros factores que favorecen la eliminación son la fuerza de la base, con el sustrato benzoato menos básico, el bromuro de isopropilo reacciona con 55% de sustitución. En general, las reacciones en fase gaseosa y las reacciones en fase solución, de este tipo, siguen la misma tendencia, aunque en el primer caso, los efectos del solvente son eliminados.
Véase también
- Reacción de sustitución
- Reacción SN1
- SNi
- Sustitución nucleofílica aromática
- Sustitución nucleofílica acílica
- Asistencia anquimérica
- Reacción de Finkelstein
- Christopher Kelk Ingold
Referencias
- ↑ Gas Phase Studies of the Competition between Substitution and Elimination Reactions Scott Gronert Acc. Chem. Res.; 2003; 36(11) pp 848 - 857; (Article) doi 10.1021/ar020042n
- ↑ La técnica usada es ionización por electrospray, y debido a que requiere productos de reacción cargados para la detección, el nucleófilo es equipado con un grupo aniónico sulfonico adicional, no reactivo y bien separado del otro anión. La razón entre el producto de sustitución y el producto de eliminación puede ser medida a partir de la intensidad de sus iones moleculares relacionados









