La Reacción de Zincke es una reacción orgánica en la cual una piridina es transformada en una sal de piridinio por reacción con 2,4-dinitro-clorobenceno y una amina primaria. La reacción fue nombrada en honor a Theodor Zincke.[1][2][3]

La reacción Zincke no se debe confundir con la reacción de Zincke-Suhl o la nitración de Zincke. Por otra parte, la reacción Zincke no tiene nada que ver con el zinc elemento químico.
Mecanismo de reacción
La primera reacción es la formación de la sal de N-2,4-dinitrofenil-piridinio (2). Esta sal se puede aislar y purificar por recristalización.

Si se calienta una amina primaria con la sal de N-2 ,4-dinitrofenil-piridinio (2), la adición de la amina provoca la apertura del anillo de piridinio. Una segunda adición de la amina conduce al desplazamiento de la 2,4-dinitroanilina (5) y la formación de la sal de König.[4] (6a y 6b). El isómero trans-cis-trans de la sal König (6a) puede reaccionar ya sea por transposición sigmatrópica o por adición nucleofílica de un intermediario zwitteriónico para dar el intermediario cíclico (7).[5] Se ha propuesto que este es el paso determinante de la velocidad.[6][7] Después de la transferencia de protones y la eliminación de aminas, se forma el ion piridinio deseado (9).

Este mecanismo puede ser referido como un caso de Adición Nucleofílica (AN), Apertura de Anillo y Cierre de Anillo (ANRORC, por sus siglas en inglés).
Aplicaciones
En una aplicación en la síntesis de fase sólida, la amina forma una unión covalente a una resina de Wang.[8]

Otro ejemplo es la síntesis de una sal quiral de isoquinolinio.[9]

Aldehídos de Zincke
Los aldehídos de Zincke, o 5-aminopenta-2,4-dienales, son el producto de una sal de piridinio con dos equivalentes de una amina secundaria, seguida de hidrólisis básica. Utilizando aminas secundarias se produce la reacción de Zincke.[1][2][3] El uso de bromuro de cianógeno para la activación de la piridina fue reportado de manera independiente por W. König:[10]

La síntesis y utilidad de aldehídos de Zincke ha sido ampliamente estudiada.[11][12][13]
Una variación de la reacción de Zincke ha sido aplicada en la síntesis de nuevos indoles:[14]

en donde se utiliza bromuro de cianógeno mediado por la activación de la piridina (método de König).
Más recientemente, una transposición interesante de los aldehídos de Zincke a amidas insaturadas con conformación Z fue descubierta por accidente mientras trataba de efectuar una reacción de Diels-Alder intramolecular.[15] La transposición se lleva a cabo como un producto Z estereospecífico. En un documento de seguimiento, fueron utilizadas aminas alílicas y se obtuvieron los productos de una transposición en cascada y una intramolecular de Diels-Alder.[16] Los detalles del mecanismo fueron discutidos, y revelaron un mecanismo inusual con una cetena vinílica calculado por medio de estudios computacionales.[17]


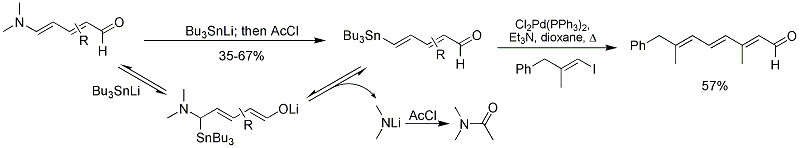
El grupo de Vanderwal ha reportado la síntesis de 4-estannildienales de aldehídos de Zincke por adición de un anión tributilestannilo y cloruro de acetilo.[18] Los productos son sustratos útiles para reacciones de copulación de Stille] para sintetizar polienos.
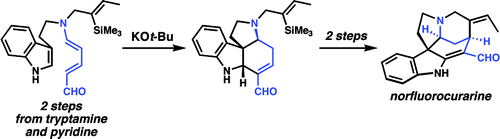
En 2009, el grupo de Vanderwal[19] reportó otra reacción de transposición de los aldehídos de Zincke. Los aldehídos de Zincke derivados de la triptamina se calientan con una base fuerte para dar un aldehído insaturado. Esta reacción fue el paso clave en la síntesis total de la fluoronorcurarina, un alcaloide del estricnano.[20] Esta estrategia ha sido empleada también en la síntesis más corta reportada de la estricnina, con tan sólo 6 pasos.[21] This works has been highlighted on the blog Totally Synthetic.
Se compara la Síntesis clásica de la estricnina:
Y la síntesis de la estricnina de Vanderwal

Los primeros reportes de los aldehídos de Zincke participando en una reacción de Pictet-Spengler aparecieron del grupo de Delpech y posteriormente Christian Marazano.[22] Esta reacción produjo tanto tetrahidro-β-carbolinas como tetrahidroisoquinolinas. Estas estructuras se encuentran en productos naturales alcaloides, y han sido utilizadas en su síntesis total. A continuación se muestra Una reacción de Pictet−Spengler sobre el N-cilo por tratamiento de triptamina y homoveratrilamina derivada de aminopentadienales con TFAA:
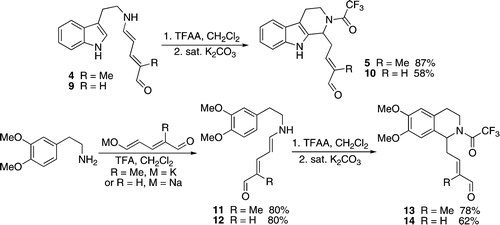
Uno de los inconvenientes de la síntesis de aldehídos de Zincke es la necesidad de 2 equivalentes de una amina en la reacción de apertura del anillo de piridina inicial. Esto es de particular interés para el caso de aminas secundarias complejas requeridas para la síntesis de productos naturales. El grupo de Michel ha descubierto recientemente una síntesis alternativa por la condensación en una variedad de derivados del glutaconaldehído con TFA. Esta solución ha simplificado enormemente la producción y purificación del complejo de los aldehídos Zincke.[23]
Debate en 2007
En 2006 y 2007 la reacción Zincke fue “redescubierta” por un grupo de investigadores en Japón[24] e independientemente, por un grupo de estadounidenses.[25] Ambos grupos reportararon la síntesis de un diaza-anuleno de 12 miembros (estructura 1) de cloruro de N-aril piridinio y una amina, ya sea una amina alifática (reportada por los norteamericanos) o una anilina (reportada por los japoneses).
En una carta a Angewandte Chemie, el químico alemán Manfred Christl[26] señaló no sólo que la “nueva” reacción era en realidad la reacción de Zincke reportada 100 años antes, sino también que la estructura propuesta para el producto de reacción no era el anillo de 12 miembros, sino la sal de piridinio de 6 miembros (estructura 2). Inicialmente ambos grupos admitieron que habían ignorado la literatura existente sobre Zincke, pero se aferraron a que los resultados de la estructura del anuleno, sobre la base de la ionización por electrospray (ESI), demuestran claramente que es un dímero. En su carta, Christl comentó que en las mediciones de ESI asociación de moléculas es un fenómeno común. Además, señaló las similitudes en el punto de fusión y la espectroscopia de RMN.
En diciembre de 2007 el grupo japonés se retractó de su papel en las cartas orgánicas debido a las incertidumbres con respecto a qué productos se forman en la reacción descrita y el grupo de EE. UU. agregó una corrección a los suyos en el Angewandte Chemie indicando que “deseaban alterar la estructura propuesta para el anuleno[27] El asunto recibió la atención de los medios:[28][29]
Referencias
- ↑ a b Zincke, Th.; Heuser, G.; Moller, W. (1904). «Ueber Dinitrophenylpyridiniumchlorid und dessen Umwandlungsproducte». Justus Liebigs Annalen der Chemie 333 (2–3): 296-345. doi:10.1002/jlac.19043330212.
- ↑ a b Zincke, Th.; Heuser, G.; Moller, W. (1904). «Ueber Dinitrophenylpyridiniumchlorid und dessen Umwandlungsproducte». Justus Liebigs Annalen der Chemie 330 (2): 361-374. doi:10.1002/jlac.19043300217.
- ↑ a b Zincke, T. H.; Weisspfenning, G. (1913). «Über Dinitrophenylisochinoliniumchlorid und dessen Umwandlungsprodukte». Justus Liebigs Annalen der Chemie 396 (1): 103-131. doi:10.1002/jlac.19133960107.
- ↑ König, W. (1904). «Über eine neue, vom Pyridin derivierende Klasse von Farbstoffen». Journal für Praktische Chemie 69 (1): 105-137. doi:10.1002/prac.19040690107.
- ↑ Kunugi, S.; Okubo, T.; Ise, N. (1976). «A study on the mechanism of the reaction of N-(2,4-dinitrophenyl)-3-carbamoylpyridinium chloride with amines and amino acids with reference to effect of polyelectrolyte addition». Journal of the American Chemical Society 98 (1): 2282-2287. PMID 1254864. doi:10.1021/ja00424a047.
- ↑ Marvell, E. N.; Caple, G.; Shahidi, I. J. Am. Chem. Soc. 1970, 92, 5641-5645. (doi 10.1021/ja00722a016)
- ↑ Marvell, E. N.; Shahidi, I. J. Am. Chem. Soc. 1970, 92, 5646-5649. (doi 10.1021/ja00722a017)
- ↑ "The Solid-Phase Zincke Reaction: Preparation of -Hydroxy Pyridinium Salts in the Search for CFTR Activation" Eda, M.; Kurth, M. J.; Nantz, M. H. J. Org. Chem. 2000, 65(17), 5131 - 5135. (doi 10.1021/jo0001636)
- ↑ New Chiral Isoquinolinium Salt Derivatives from Chiral Primary Amines via Zincke Reaction Denis Barbier, Christian Marazano, Bhupesh C. Das, and Pierre Potier J. Org. Chem.; 1996; 61(26) pp 9596 - 9598; (Note) doi 10.1021/jo961539b
- ↑ König, W. (1904). «Über eine neue, vom Pyridin derivierende Klasse von Farbstoffen». J. Prakt. Chem. 69 (1): 105-137. doi:10.1002/prac.19040690107.
- ↑ Becher, J. (1980). Synthesis: 589-612.
- ↑ Becher, J.; Finsen, L.; Winckelmann, I. (1981). «Derivatives and reactions of glutaconaldehyde—XIII Regiospecific ring opening of 3-substituted pyridines». Tetrahedron 37 (13): 2375-2378. doi:10.1016/S0040-4020(01)88892-X.
- ↑ Cheng, W.-C.; Kurth, M. J. (2002). Org. Prep. Proced. Int. 34: 587-608.
- ↑ Synthesis of Nitrogen Heterocycles by the Ring Opening of Pyridinium Salts Aaron M. Kearney, Christopher D. Vanderwal Angew. Chem. Int. Ed. 2006, 45, 7803 –7806 doi 10.1002/anie.200602996
- ↑ Steinhardt, S.E.; Silverston, J.S.; Vanderwal, C.D. (2008). «Stereocontrolled Synthesis of Z-Dienes via an Unexpected Pericyclic Cascade Rearrangement of 5-Amino-2,4-pentadienals». J. Am. Chem. Soc. 130 (24): 7560-7561. PMID 18505251. doi:10.1021/ja8028125.
- ↑ Steinhardt, S.E.; Vanderwal, C.D. (2009). «Complex Polycyclic Lactams from Pericyclic Cascade Reactions of Zincke Aldehydes». J. Am. Chem. Soc. 131 (22): 7546-7547. PMID 19449870. doi:10.1021/ja902439f.
- ↑ Paton, R.S.; Steinhardt, S.E.; Vanderwal, C.D.; Houk, K.N. (2011). «Stereocontrolled Synthesis of Z-Dienes via an Unexpected Pericyclic Cascade Rearrangement of 5-Amino-2,4-pentadienals». J. Am. Chem. Soc. 133 (11): 110225105431045. doi:10.1021/ja107988b.
- ↑ Michels, T.; Rhee, J.U.; Vanderwal, C.D. (2008). «Synthesis of delta-Tributylstannyl Unsaturated Aldehydes from Pyridines». Org. Lett. 10 (21): 4787-4790. PMID 18817407. doi:10.1021/ol8020435.
- ↑ [1]
- ↑ Martin, D.B.C.; Vanderwal, C.D. (2009). «Efficient Access to the Core of the Strychnos, Aspidosperma and Iboga Alkaloids. A Short Synthesis of Norfluorocurarine». J. Am. Chem. Soc. 131 (10): 3472-3473. PMID 19236094. doi:10.1021/ja900640v.
- ↑ Martin, D.B.C.; Vanderwal, C.D. (2011). «A Synthesis of Strychnine by a Longest Linear Sequence of Six Steps». Chemical Science 2 (4): 649. doi:10.1039/C1SC00009H.
- ↑ Nuhant, P.; Raikar, S.B.; Wypych, J.-C.; Delpech, B.; Marazano, C. (2009). «Enhancement of 5-Aminopenta-2,4-dienals Electrophilicity via Activation by O,N-Bistrifluoroacetylation. Application to an N-Acyl Pictet−Spengler Reaction». J. Org. Chem. 74 (24): 9413-21. PMID 19924881. doi:10.1021/jo9019545.
- ↑ T. Nguyen, S. Peixoto, C. Ouairy, T. Nguyen, M. Bénéchie, C. Marazano†*, P. Michel* (2010). «Simple and Convenient Method for the Synthesis of 2-Substituted Glutaconaldehyde Salts and 2-Substituted Glutaconaldehyde Derivatives». Synthesis 2010 (01): 103. doi:10.1055/s-0029-1217105.
- ↑ One-Pot Synthesis of N-Substituted Diaza[12]annulenes Yamaguchi, I.; Gobara, Y.; Sato, M. Org. Lett.; (Letter); 2006; 8(19); 4279-4281. doi 10.1021/ol061585q
- ↑ [12]Annulene Gemini Surfactants: Structure and Self-Assembly Lei Shi, Dan Lundberg, Djamaladdin G. Musaev, Fredric M. Menger Angewandte Chemie International Edition Volume 46, 2007 Issue 31 , Pages 5889 - 5891 doi 10.1002/anie.200702140
- ↑ (en alemán) 1,7-Diaza[12]annulene Derivatives? 100-Year-Old Pyridinium Salts! (p 9152-9153)Manfred Christl Published Online: Nov 28 2007 5:47AM doi 10.1002/anie.200704704
- ↑ Corrigendum [12]Annulene Gemini Surfactants: Structure and Self-Assembly Lei Shi, Dan Lundberg, Djamaladdin G. Musaev, Fredric M. Menger Angewandte Chemie International Edition Volume 46, 2007, Issue 48, Pages 9152 - 9153 doi 10.1002/anie.200790248
- ↑ (en alemán) Ahnungslose Chemiker entdecken Verbindung zum zweiten Mal. Jens Lubbadeh Der Spiegel 6 December 2007 http://www.spiegel.de/wissenschaft/natur/0,1518,521646,00.html
- ↑ Where have I seen that before? 103-year-old chemical reaction pops up again. Katharine Sanderson. Published online 4 December 2007 | Nature | doi 10.1038/news.2007.341









